题目内容
[化学-物质结构与性质]
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为______,请解释金属铜能导电的原因______.
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列______.
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有______.
(2)已知:下表是14种元素的电负性的数值(用X表示).
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键,如NaCl;当小于1.7时,一般为共价键,如AlCl3.请写出铁元素和表中非金属元素形成的常见共价化合物:______.
②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为______.
③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)______,其分子空间构型为______.
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为______,请解释金属铜能导电的原因______.
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列______.
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有______.
(2)已知:下表是14种元素的电负性的数值(用X表示).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为______.
③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)______,其分子空间构型为______.
(1)①铜是29号元素,该原子核外有29个电子,4S能级能量小于3d能级能量,根据能量最低原理,电子先排4s能级后排3d能级,但轨道处于全满、半满、全空时原子最稳定,所以铜的核外电子排布式为[Ar]3d104s1;
铜是金属晶体,金属晶体是由金属阳离子和自由电子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电,
故答案为:[Ar]3d104s1;铜是由自由电子和金属阳离子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电;
②Ni(CO)4采取SP3杂化,是正四面体结构,所以属于非极性分子,根据相似相溶原理,非极性溶质易溶于非极性溶剂,苯和四氯化碳是非极性分子,所以Ni(CO)4易溶于苯和四氯化碳,故答案为:bc;
③[Cu(NH3)4]SO4中[Cu(NH3)4]2+和 SO4 2-之间存在离子键,Cu和NH3之间存在配位键,N、H原子间存在共价键,所以[Cu(NH3)4]SO4中除存在普通共价键外,还有离子键、配位键.
故答案为:离子键、配位键;
(2)①当形成化学键的两原子相应元素的X差值小于1.7时,一般为共价键,铁的电负性为1.8,所以非金属的电负性小于3.5,且形成的化合物为常见化合物,所以为FeCl3或FeS.
故答案为:FeCl3或FeS;
②氯化铝为共价化合物,氯原子提供孤对对子,铝原子提供空轨道,形成配位键,使所有原子均达到8电子稳定结构,所以结构式为
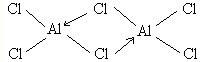
.
故答案为:

;
③根据题意知,分子中含有双键,原子和原子间能形成双键的有CO2或CS2;空间构型为直线型.
故答案为:CO2或CS2;直线型.
铜是金属晶体,金属晶体是由金属阳离子和自由电子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电,
故答案为:[Ar]3d104s1;铜是由自由电子和金属阳离子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电;
②Ni(CO)4采取SP3杂化,是正四面体结构,所以属于非极性分子,根据相似相溶原理,非极性溶质易溶于非极性溶剂,苯和四氯化碳是非极性分子,所以Ni(CO)4易溶于苯和四氯化碳,故答案为:bc;
③[Cu(NH3)4]SO4中[Cu(NH3)4]2+和 SO4 2-之间存在离子键,Cu和NH3之间存在配位键,N、H原子间存在共价键,所以[Cu(NH3)4]SO4中除存在普通共价键外,还有离子键、配位键.
故答案为:离子键、配位键;
(2)①当形成化学键的两原子相应元素的X差值小于1.7时,一般为共价键,铁的电负性为1.8,所以非金属的电负性小于3.5,且形成的化合物为常见化合物,所以为FeCl3或FeS.
故答案为:FeCl3或FeS;
②氯化铝为共价化合物,氯原子提供孤对对子,铝原子提供空轨道,形成配位键,使所有原子均达到8电子稳定结构,所以结构式为

.
故答案为:

;
③根据题意知,分子中含有双键,原子和原子间能形成双键的有CO2或CS2;空间构型为直线型.
故答案为:CO2或CS2;直线型.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目

 ,平面结构)属于
,平面结构)属于 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】