��Ŀ����
����Ŀ����ͭ��(��Ҫ�ɷ���CuFeS2)��һ����Ҫ�Ļ���ԭ�ϣ�ͨ����ѧ���տɻ�ö�(��������)��ͭ[Cu(NH2CH2CH2COO)2]�Ȳ�Ʒ��
��1��Cu2+��̬��������Ų�ʽΪ________
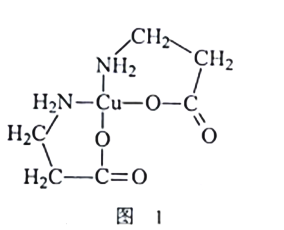
��2��[Cu(NH2CH2CH2COO)2]�Ľṹ��ʽ��ͼ1��ʾ��1mol[Cu(NH2CH2CH2COO)2]�к���������ĿΪ_______��C��N��O����Ԫ�صĵ�һ��������С�����˳����__________
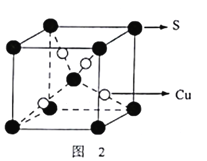
��3����ͭ���ڿ��������յõ������������������SO2������������SO3��SO2������Sԭ�ӹ�����ӻ�����Ϊ_____��SO3���ӵĿռ乹��Ϊ______�����������к���һ�ֻ�����X���侧����ͼ2��ʾ��������X�Ļ�ѧʽΪ____________��
 ��
��
���𰸡� [Ar]3d9��1s22s22p63s23p63d9 26NA C<O<N sp2 ƽ�������� Cu2S
����������1��Cu��29��Ԫ�أ�������Ų�ʽΪ1s22s22p63s23p63d104s1��ת��ΪCu2+��ʱ��Ӧ��ʧȥ�������������ӣ�������1s22s22p63s23p63d9��[Ar]3d9��
��2������ͼ1�Ľṹͼ��ÿһ���������ǦҼ���˫����һ���Ҽ���һ���м�������������һ����26���Ҽ�����1mol[Cu(NH2CH2CH2COO)2]�к���������ĿΪ26NA��ͬ���ڴ������ҵ�һ����������������N��2p�ܼ��İ����ȶ��ṹ�����Է�������˳��Ϊ��C<O<N��
��3�����ݼ۲���ӶԻ������ۣ�SO2������ԭ��S�ļ۵��Ӷ�Ϊ��2+(6-2��2)/2��3�ԣ�����S��sp2�ӻ������ݼ۲���ӶԻ������ۣ�SO3������ԭ��S�ļ۵��Ӷ�Ϊ��3+(6-3��2)/2��3�ԣ�����SO3��ƽ����������ͼ2��Sռ�ݶ�������ģ�����S��8��![]() + 1 = 2����Cu���ھ����ڲ�������Cu��4�������Ի�ѧʽΪCu2S��
+ 1 = 2����Cu���ھ����ڲ�������Cu��4�������Ի�ѧʽΪCu2S��

 �ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д�
�ǻۿ����ܾ�100�ֵ�Ԫ���ؼ��ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
ʵ��Ŀ�� | ʵ�鷽�� | |
A | ����FeSO4�����Ƿ����������� | ��FeSO4��Ʒ����ϡ�����,�μ�KSCN��Һ,�۲���Һ�Ƿ��� |
B | ̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�� | ȡ��֧�Թ�,������4mL0.5mol/L��KMnO4������Һ,Ȼ������֧�Թ��зֱ����2mL0.1mol/LH2C2O4(����)��Һ��2mL0.2mol/LH2C2O4��Һ�ȽϷ�Ӧ��ɫ�Ŀ��� |
C | �ᴿ��������������������� | ����������������������м����������̼������Һ,���÷�Һ,����ȥ�л����е�ˮ |
D | �жϵ����Ƿ�ˮ�� | ����ϡ�����������ĵ���ˮ��Һ�м�������������Һ��ˮԡ���ȣ��۲��Ƿ�������� |
A. A B. B C. C D. D
����Ŀ������ʵ���ܴﵽԤ��Ŀ�ĵ���
��� | ʵ������ | ʵ��Ŀ�� |
A | ��FeCl3������������Ũ�����У��ټ�����ˮϡ��������Ũ�� | �����Ȼ�����Һ |
B | �����£����ɵ�ص��¶����ߵ�40����������������� | ֤���ɵ�ؿɽ���������ת��Ϊ���� |
C | ��CuCl2��Һ�м���NaOH����pH>4 | ��ȥCuCl2��Fe3+���� |
D | ��BaSO4����Һ�м���Na2CO3������Һ�����˳��ij��������������������� | ֤��Ksp(BaCO3)<Ksp(BaSO4) |
A. A B. B C. C D. D