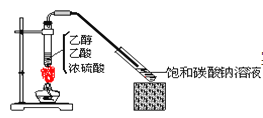
��Ŀ����
����Ŀ��ʵ���ҴӺ����Һ![]() ����
����![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �л��յ⣬�����������£�
�л��յ⣬�����������£�

![]() ���Һ�м���
���Һ�м���![]() ��Һ����������ԭ����Ӧ�����ӷ���ʽΪ ______��
��Һ����������ԭ����Ӧ�����ӷ���ʽΪ ______��
![]() ��������������������ƿ�н��У�����Һ���������pHԼΪ2������ͨ��
��������������������ƿ�н��У�����Һ���������pHԼΪ2������ͨ��![]() ��ʵ����ˮԡ������
��ʵ����ˮԡ������![]() ���ҵĽϵ��¶��½��е�ԭ���� ______��
���ҵĽϵ��¶��½��е�ԭ���� ______��

![]() ij�о�С����ͼװ�ö�
ij�о�С����ͼװ�ö�![]() ��KI��Һ�ķ�Ӧ����̽��������ͨ��
��KI��Һ�ķ�Ӧ����̽��������ͨ��![]() һ��ʱ���KI��Һ��Ϊ��ɫ������ͨ��
һ��ʱ���KI��Һ��Ϊ��ɫ������ͨ��![]() ������Һ��ɫ��dz������Ϊ��ɫ���о�С���������ɫ��Һ�е�Ԫ�صĴ�����̬��������¼��裺
������Һ��ɫ��dz������Ϊ��ɫ���о�С���������ɫ��Һ�е�Ԫ�صĴ�����̬��������¼��裺

����һ��û��![]() ��̬���������û��
��̬���������û��![]() ��̬������������
��̬������������![]() ��̬��
��̬��
![]() �����ʵ��֤������һ����
�����ʵ��֤������һ����![]() �Լ���ѡ
�Լ���ѡ![]() ��
��
ʵ����� | Ԥ������ | ���� |
_______ | _______ | ����һ���� |
![]() ���������������������
����������������д������![]() �����ӷ���ʽ ______��
�����ӷ���ʽ ______��
![]() ���о�С�黹�����˶Լӵ�����
���о�С�黹�����˶Լӵ�����![]() �����ⶨ������ʵ�飺
�����ⶨ������ʵ�飺
![]() ȷ��ȡ�ӵ���mg���ձ��У�������������ˮ������KI���ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���
ȷ��ȡ�ӵ���mg���ձ��У�������������ˮ������KI���ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���![]() ������Һ����ȡ
������Һ����ȡ![]() ������Һ����ƿ�У��Ӽ��ε�����Һ����c
������Һ����ƿ�У��Ӽ��ε�����Һ����c![]()
![]() ��Һ�ζ����յ㣬�ظ�3�Σ����ƽ��ֵΪVmL��
��Һ�ζ����յ㣬�ظ�3�Σ����ƽ��ֵΪVmL��
��֪��![]() ��
��![]() ���ⶨʱ���жϴﵽ�ζ��յ������Ϊ ______ ���ɲⶨ���ݿ���ø���Ʒ�к�
���ⶨʱ���жϴﵽ�ζ��յ������Ϊ ______ ���ɲⶨ���ݿ���ø���Ʒ�к�![]() ����������Ϊ ______
����������Ϊ ______ ![]() �ú�m��c��V�Ĵ���ʽ��ʾ��
�ú�m��c��V�Ĵ���ʽ��ʾ��![]()
![]() ��
��
![]() �ڵζ�������ȷ���������£��ô��ֲⶨ������õĽ������ƫ�ߣ���ԭ�����ܿ�����Ӱ�죬�������ӷ���ʽ��ʾ������һӰ���ԭ�� ______��
�ڵζ�������ȷ���������£��ô��ֲⶨ������õĽ������ƫ�ߣ���ԭ�����ܿ�����Ӱ�죬�������ӷ���ʽ��ʾ������һӰ���ԭ�� ______��
���𰸡�![]() ʹ��������Һ���нϴ���ܽ��
ʹ��������Һ���нϴ���ܽ��![]() ���ֹ
���ֹ![]() �������ֹ
�������ֹ![]() ��һ��������
��һ��������![]()
![]() ȡ������ɫ��Һ�������м��������Һ ��Һ������ ��Һ����ɫ��Ϊ��ɫ���Ұ���Ӳ���ɫ
ȡ������ɫ��Һ�������м��������Һ ��Һ������ ��Һ����ɫ��Ϊ��ɫ���Ұ���Ӳ���ɫ ![]()
![]()
��������
![]() ����������Ӿ���ǿ�Ļ�ԭ���ܹ���ԭ���ʵ⣻
����������Ӿ���ǿ�Ļ�ԭ���ܹ���ԭ���ʵ⣻
![]() �¶�Խ�ߣ������ܽ��ԽС��
�¶�Խ�ߣ������ܽ��ԽС��
![]() �����������۱���ɫ��
�����������۱���ɫ��
![]() �����ɵ�������ӣ���������������ķ�Ӧ�����ݵ�ʧ�����غ㡢ԭ�Ӹ����غ�д����Ӧ����ʽ��
�����ɵ�������ӣ���������������ķ�Ӧ�����ݵ�ʧ�����غ㡢ԭ�Ӹ����غ�д����Ӧ����ʽ��
![]() ��Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Һ��ʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㣻
��Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Һ��ʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㣻
���ݹ�ϵʽ![]() ���м��㣻
���м��㣻
![]() ʵ���ý��ƫ�ߣ�˵���ζ����ĵ�
ʵ���ý��ƫ�ߣ�˵���ζ����ĵ�![]() ��Һ���ƫ�ߣ���Һ�е�ĺ���ƫ�ߣ�Ӧ�����ɵĵ����ӱ���������Ϊ�����¡�
��Һ���ƫ�ߣ���Һ�е�ĺ���ƫ�ߣ�Ӧ�����ɵĵ����ӱ���������Ϊ�����¡�
![]() �������������ⷢ��������ԭ��Ӧ�����ӷ���ʽ��
�������������ⷢ��������ԭ��Ӧ�����ӷ���ʽ��![]() ��
��
![]() �¶�Խ�ߣ������ܽ��ԽС��Ϊ���������ܽ������Ӧ�����ڵ��������£�
�¶�Խ�ߣ������ܽ��ԽС��Ϊ���������ܽ������Ӧ�����ڵ��������£�
![]() �ⵥ���������۱���ɫ��������������ɫ��Һ�м��������Һ����������ɫ��˵�������ڵ⣻
�ⵥ���������۱���ɫ��������������ɫ��Һ�м��������Һ����������ɫ��˵�������ڵ⣻
�ʴ�Ϊ��
ʵ����� | Ԥ������ |
ȡ������ɫ��Һ�������м��������Һ | ��Һ������ |
![]() �������������������������ⵥ�����ɵ�������ӣ���������ԭΪ�����ӣ����ݵ�ʧ�����غ���ɡ�ԭ�Ӹ����غ���ɣ��÷�Ӧ�����ӷ���ʽ��
�������������������������ⵥ�����ɵ�������ӣ���������ԭΪ�����ӣ����ݵ�ʧ�����غ���ɡ�ԭ�Ӹ����غ���ɣ��÷�Ӧ�����ӷ���ʽ��![]() ��
��
![]() �������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��
�������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��![]() ��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㣻
��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㣻
����Ʒ��![]() ����������Ϊa����
����������Ϊa����
![]()
214 6
ma![]() ��
��
��ã�![]() ��
��
![]() ʵ���ý��ƫ�ߣ�˵���ζ����ĵ�
ʵ���ý��ƫ�ߣ�˵���ζ����ĵ�![]() ��Һ���ƫ�ߣ���Һ�е�ĺ���ƫ�ߣ�Ӧ�����ɵĵ����ӱ���������Ϊ�⣬ͬʱ����ˮ����Ӧ���ӷ���ʽΪ
��Һ���ƫ�ߣ���Һ�е�ĺ���ƫ�ߣ�Ӧ�����ɵĵ����ӱ���������Ϊ�⣬ͬʱ����ˮ����Ӧ���ӷ���ʽΪ![]() ��
��

����Ŀ��A~H���ֶ���������Ԫ�������ڱ��е����λ����ͼ��ʾ����֪CԪ���γɵĵ�������������������������![]() ������ϼ�����ͻ��ϼ�֮��Ϊ2���ش��������⣺
������ϼ�����ͻ��ϼ�֮��Ϊ2���ش��������⣺
A | ���� | D | E | F | ||
B | C | ���� | G | H |
(1)DԪ�������ڱ��е�λ��Ϊ________________��
(2)����Ԫ�����γɵ���̬����������������ˮ��������________________(�ѧʽ)��
(3)B�ĵ�����F�ĵ�����ȼ�յĻ�����ɫΪ________��
(4)CԪ�صĵ��ʿ�����D��F�γɵ�һ����̬��������ȼ�գ�д���÷�Ӧ�Ļ�ѧ����ʽ_____