题目内容
某二元酸(化学式用H2A表示)在水中的电离方程式是H2A===H++HA-,HA-?H++A2-。回答下列问题:
(1)Na2A溶液显(填“酸性”、“中性”或“碱性”),理由是(用离子方程式或必要的文字说明)。
(2)常温下,已知0.1mol·L-1NaHA溶液pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能0.11mol·L-1(填“大于”、“等于”或“小于”),理由是。
(3)0.1mol·L-1N aHA溶液中各种离子浓度由大到小的顺序是。
aHA溶液中各种离子浓度由大到小的顺序是。
(4)Na2A溶液中,下列表述正确的是。
A.cNa++cH+=cHA-+2cA2-+cOH—
B.cNa+=2(cHA-+cA2-+cH2A)
C.cOH—=cHA-+cH++2cH2A
D.cOH—=cHA-+cH+
练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
1.相同温度的下列溶液:①0.1mol•L-1的硫酸 ②0.01mol•L-1的NaOH溶液,其中由水电离产生的[H+]之比为( )
| A. | 1:1 | B. | 1:10 | C. | 1:20 | D. | 20:1 |




 g
g g
g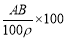 g
g
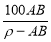 g
g 常压下,1molSO2的体积为22.4L
常压下,1molSO2的体积为22.4L
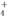 )=c(Cl-)
)=c(Cl-)