题目内容
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
② 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =" —1268" kJ/mol ②副反应
2N2(g)+6H2O(g) △H =" —1268" kJ/mol ②副反应
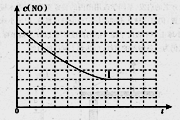
有关物质产率与温度的关系如甲图。
(1)由反应①②可知反应⑤N2(g) + O2(g) 2NO(g)的反应热ΔH=
2NO(g)的反应热ΔH=
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二: (用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为 。
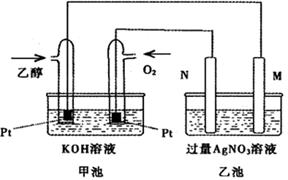
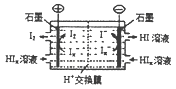
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 (填“正极”或“负极”),电极方程式为
(12分)(每空2分)
(1) +181.5 kJ/mol
(2) 780℃~840℃
(3) 抑制Fe3+的水解;Fe3++3H2O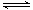 Fe(OH)3+3H+
Fe(OH)3+3H+
(4) 2NH3+ClO—=N2H4+Cl—+H2O
(5) 负极 2NH3—6e—+6OH—=N2+6H2O
解析试题分析:(1)由盖斯定律,(①-②)×1/2可得N2(g)+O2(g)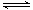 2NO(g),故△H=1/2×(1)由盖斯定律,(①-②)×1/2可得N2(g)+O2(g)
2NO(g),故△H=1/2×(1)由盖斯定律,(①-②)×1/2可得N2(g)+O2(g)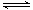 2NO(g),故△H="+181.5" kJ·mol-1,
2NO(g),故△H="+181.5" kJ·mol-1,
故答案为:+181.5 kJ·mol-1;
(2)从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择780~840℃,
故答案为:780~840℃;
(3)溶液中铁离子水解Fe3++3H2O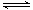 Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解,
Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解,
故答案为:溶液中铁离子水解Fe3++3H2O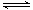 Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解;
Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解;
(4)NH3通入NaClO溶液中,生成N2H4,N元素的化合价升高,故Cl元素的化合价应降低,有氯离子生成,根据元素守恒与电荷守恒可知,还有水生成,配平后离子方程式为:2NH3+ClO-=N2H4+Cl-+H2O,
故答案为:2NH3+ClO-=N2H4+Cl-+H2O;
(5)由图可知,A极通入的为氨气,发生氧化反应,为负极,氨气在碱性条件下放电生成氮气与水,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:负极;2NH3-6e-+6OH-=N2+6H2O.
考点:化学平衡的调控作用;化学电源新型电池

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
(1)已知:C(石墨)+CO2(g) 2CO(g) △H=" +" 172.5 kJ·mol-1
2CO(g) △H=" +" 172.5 kJ·mol-1
则反应:Fe2O3(S) +3C(石墨) 2Fe(s)+3CO(g) △H= kJ·mol-1
2Fe(s)+3CO(g) △H= kJ·mol-1
(2)冶炼铁反应 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
(3)在ToC时,该反应的平衡常数K=27,在1L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| | Fe2 O3 | CO | Fe | CO2 |
| 甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
| 乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
①甲容器中CO的平衡转化率为
②下列说法正确的是 (填字母)。
a.乙容器中CO的平衡转化率小于甲容器
b.甲、乙容器中,CO2的平衡浓度之比为2:3
c.当容器内气体压强保持不变时,标志反应达到平衡状态
d.当容器中气体密度保持不变时,标志反应达到平衡状态
(4)钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
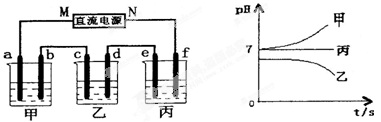
①下列哪个装置可防止铁棒被腐蚀 (填编号)。
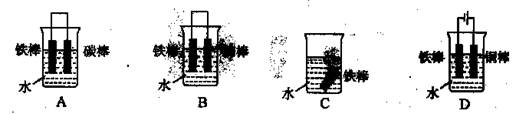
②在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 。
氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
(1)根据右下能量变化示意图:
写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1 K2(填“>”、“=”或“<”)
| T /K | 298 | 398 |
| 平衡常数K | K1 | K2 |
(3)下列各项能说明该反应达到平衡状态的是 (填字母序号)
a. v(H2)正="3" v(N2)逆
b. 容器内压强保持不变
c. 容器中混合气体的密度保持不变
d.: N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用下图实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红。
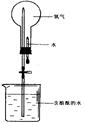
请回答:
①用化学用语说明所得氨水能使酚酞变红的原因 。
②250C时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为 (填字母序号)
a.c(Cl-)﹥c(NH4+) b.c(Cl-)﹦c(NH4+)
c. c(Cl-)﹤c(NH4+) d.无法判断
工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为 ;为了尽可能多地实现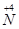 向
向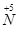 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+ 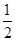 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为 ;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s | 0 | 2 | 3 | 4 |
| c(NO)/mol·L-1 | 1.00×10-3 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 | |  |  2.70×10-3 2.70×10-3 | |
①前2s内的平均反应速率v(CO)= ;
②在该温度下,反应的平衡常数K= ;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序 。
 4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下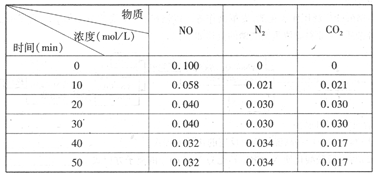
 N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。