题目内容
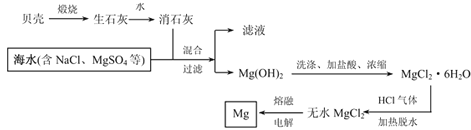
【题目】根据下图回答问题:

(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。______________________________________。
(2)写出浓硫酸和木炭粉加热条件下反应的化学方程式:_______________________
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:A中加入的试剂和作用是_____________________;B中加入的试剂和作用是__________________________;D中加入的试剂和作用是____。
(4)若C中装有KMnO4溶液,则实验时C中应观察到的现象是_________________。
【答案】 反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热后,水会升到导管里形成一段水柱,证明装置不漏气 2H2SO4(浓)+C![]() 2H2O+2SO2+CO2 无水硫酸铜,检验水 品红溶液,检验二氧化硫 澄清石灰水,检验二氧化碳 酸性高锰酸钾溶液的颜色不褪尽,证明SO2被除尽。
2H2O+2SO2+CO2 无水硫酸铜,检验水 品红溶液,检验二氧化硫 澄清石灰水,检验二氧化碳 酸性高锰酸钾溶液的颜色不褪尽,证明SO2被除尽。
【解析】(1)检查气密性时,由于装置较多,双手的热量不足以使整个装置中气体膨胀,效果不明显,因而在B、C、D洗气瓶的导管口见不到气泡冒出,所以在反应前用小火加热(或其他方法),使瓶内空气迅速膨胀,导致气泡从洗气瓶的导管中冒出,停止加热后,烧瓶冷却,瓶内压力减小,产生负压,水会升到洗气瓶的导管里,形成一段水柱,由此证明装置不漏气。
(2)浓H2SO4与木炭反应生成H2O(g),SO2(g),CO2(g)三种物质,化学方程式为:2H2SO4(浓)+C![]() 2H2O↑+2SO2↑+CO2↑。
2H2O↑+2SO2↑+CO2↑。
(3)可以用无水硫酸铜检验其中的H2O(g),白色无水CuSO4吸水后变为蓝色CuSO4·5H2O;SO2可以使品红溶液褪色;由于SO2和CO2都能使澄清石灰水变浑浊,所以要证明气体中有CO2,先要确认气体中已经不再有SO2。因此在装置中,容器A中的试剂是无水CuSO4、B中是品红溶液、D中是澄清石灰水。由于酸性KMnO4溶液具体强氧化性,而SO2具有还原性,两者可发生氧化还原反应,因此,C中可加入酸性KMnO4溶液,用来除去剩余的SO2气体。在实验时,C中应观察到的现象是酸性KMnO4溶液的颜色不褪尽,这样才能说明SO2已经除尽,使澄清石灰水变浑只能是气体中有CO2。
(4)由上述分析可得:酸性高锰酸钾溶液的颜色不褪尽,证明SO2被除尽。

 阅读快车系列答案
阅读快车系列答案