题目内容
【题目】下列推断正确的是 ( )
A. BF3是三角锥形分子
B. NH![]() 的电子式:
的电子式: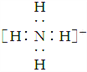 ,离子呈平面形结构
,离子呈平面形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D. 正三价阳离子的电子排布式为1s2 2s2 2p6 3s2 3p6 3d5的元素周期表中位于第Ⅷ族
【答案】D
【解析】A、BF3分子中B原子没有孤对电子,是sp2杂化,分子的空间构型是平面正三角形结构,选项A错误;B、NH4+离子中N原子形成成4个σ键,N原子是sp3型杂化,杂化轨道全部用于成键,N原子连接4个相同的原子,为正四面体构型,键角是109°28′,选项B错误;CH4分子中的4个C—H键都是碳原子的2s轨道与碳原子的2p轨道形成的sp3杂化轨道,然后分别与4个氢原子的1s轨道重叠,形成4个C—H σ键,选项C错误;D、由离子的电子排布式可推出原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布为3d64s2,因为排布在d、s轨道,所以为副族,因为共有8个价电子,所以为Ⅷ族,选项D正确。答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目