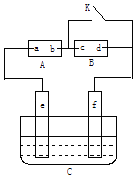
题目内容
【题目】下列热化学方程式正确的是( )
A.甲烷的燃烧热ΔH=-890.3 kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
【答案】D
【解析】甲烷的燃烧热是生成液态水时放出的热量,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故A不符合题意;
合成氨反应可逆,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)的物质的量小于1mol,故B不符合题意;
中和热是稀强酸、稀强碱反应,生成1mol水放出的热量,H2SO4和Ca(OH)2反应的中和热是ΔH=-57.3kJ·mol-1,故C不符合题意;
相同物质的量的碳完全燃烧生成二氧化碳放出的热大于生成CO放出的热,故D符合题意。
所以答案是:D

【题目】根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10﹣3 | 2.55×10﹣2 | 9×10﹣4 | 1.1×10﹣2 |
下列说法不正确的是( )
A.硫酸钙悬浊液中存在CaSO4(s)Ca2+(aq)+SO42﹣(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3 , 沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度gcm-3 | 水溶性 |
A | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是 ( )
A. 萃取 B. 蒸馏 C. 升华 D. 分液