题目内容
【题目】根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10﹣3 | 2.55×10﹣2 | 9×10﹣4 | 1.1×10﹣2 |
下列说法不正确的是( )
A.硫酸钙悬浊液中存在CaSO4(s)Ca2+(aq)+SO42﹣(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3 , 沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
【答案】D
【解析】解:A、硫酸钙悬浊液是硫酸钙的饱和溶液,存在溶解平衡,其溶解平衡的表达式为:CaSO4(s)Ca2+(aq)+SO42﹣(aq),故A正确;
B、根据Ksp可知,CaSO4的溶解度大于CaCO3的溶解度,而沉淀容易由溶解度大的向溶解度小的转化,故用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3,故B正确;
C、沉淀容易由溶解度大的向溶解度小的转化,向Mg(OH)2悬浊液中滴加FeCl3,沉淀变为红褐色,即Mg(OH)2转化为Fe(OH)3沉淀,则说明溶解度Fe(OH)3<Mg(OH)2,故C正确;
D、设产生MgCO3沉淀时所需的碳酸根的浓度为c(CO32﹣),产生Mg(OH)2沉淀是所需的氢氧根的浓度为c(OH﹣),根据MgCO3的Ksp可知:c(Mg2+)c(CO32﹣)=,根据Mg(OH)2的Ksp可知:c(Mg2+)c(OH﹣)2=9×10﹣4,即当同时产生MgCO3和Mg(OH)2沉淀时,所需的碳酸根和氢氧根的浓度之比为: ![]() =
= ![]() ,则
,则 ![]() =
= ![]() ,
, ![]() =
= ![]() =1.1:3,故产生Mg(OH)2沉淀所需的氢氧根的浓度比产生MgCO3沉淀所需的碳酸根的浓度更高,故应先产生产生MgCO3沉淀,故D错误.
=1.1:3,故产生Mg(OH)2沉淀所需的氢氧根的浓度比产生MgCO3沉淀所需的碳酸根的浓度更高,故应先产生产生MgCO3沉淀,故D错误.
故选D.
A、硫酸钙悬浊液是硫酸钙的饱和溶液,存在溶解平衡;
B、CaSO4的溶解度大于CaCO3的溶解度;
C、沉淀容易由溶解度大的向溶解度小的转化;
D、根据MgCO3和Mg(OH)2的Ksp来计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】煤燃烧排放的烟气含有SO2和NOx , 形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)SO2分子的空间构型为 .
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10﹣3molL﹣1 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子 | SO42﹣ | SO32﹣ | NO3﹣ | NO2﹣ | Cl﹣ |
c/(molL﹣1) | 8.35×10﹣4 | 6.87×10﹣6 | 1.5×10﹣4 | 1.2×10﹣5 | 3.4×10﹣3 |
①写出NaClO2溶液脱硫过程中主要反应的离子方程式 . 增加压强,SO2的转化率(填“提高”“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐 (填“提高”“不变”或“降低”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是 .
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压Pa如图所示. 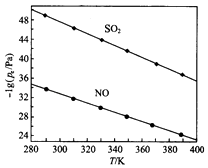
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”“不变”或“减小”).
②反应ClO2﹣+2SO32﹣=2SO42﹣+Cl﹣的平衡常数K表达式为
(4)如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 .