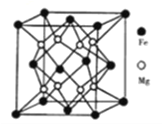
题目内容
【题目】下列反应适用于工业生产的是
A.电解熔融氯化铝可得到金属铝B.光照氯气和氢气的混合物生产盐酸
C.氯气与石灰乳作用制漂白粉D.二氧化锰和浓盐酸共热,制取氯气
【答案】C
【解析】
A.氯化铝是共价化合物,不能电解制取金属Al,在工业上用电解熔融离子化合物氧化铝来制取金属铝,A错误;
B.光照氯气和氢气的混合物会发生爆炸,不能用于生产盐酸,B错误;
C.氯气与石灰乳作用产生CaCl2、Ca(ClO)2,二者的混合物就是漂白粉的主要成分,C正确;
D.在实验室用二氧化锰和浓盐酸共热,制取氯气,在工业上用电解饱和食盐水制取氯气,D错误;
故合理选项是C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】煤燃烧排放的烟气含有SO2和NOx , 形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)SO2分子的空间构型为 .
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10﹣3molL﹣1 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子 | SO42﹣ | SO32﹣ | NO3﹣ | NO2﹣ | Cl﹣ |
c/(molL﹣1) | 8.35×10﹣4 | 6.87×10﹣6 | 1.5×10﹣4 | 1.2×10﹣5 | 3.4×10﹣3 |
①写出NaClO2溶液脱硫过程中主要反应的离子方程式 . 增加压强,SO2的转化率(填“提高”“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐 (填“提高”“不变”或“降低”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是 .
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压Pa如图所示. 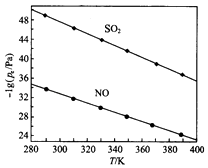
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”“不变”或“减小”).
②反应ClO2﹣+2SO32﹣=2SO42﹣+Cl﹣的平衡常数K表达式为
(4)如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 .
【题目】五种短周期主族元素W、M、X、X、Z原子序数依次增大,请结合表中信息回答下列问题:
元素 | W | M | X | Y | Z |
结构或性质 | 最高价含氧酸与其气态氢化物能发生化合反应 | 氢化物的水溶液能刻蚀玻璃 | 焰色反应呈火焰黄色 | 同周期主族元素形成的简单离子中,其离子半径最小 | 最高正价与最低负价代数和为6 |
(1)M元素在周期表中的位置为____________。
(2)M、X、Z元素所对应简单离子半径由大到小的顺序为__________(用离子符号表示)。
(3)W最高价含氧酸与其气态氢化物发生化合反应生成的物质中含有的化学键类型为_____。
(4)下列可作为比较M和Z的非金属性强弱的依据是_______(填序号)。
A.单质与H2反应的难易程度 B.氢化物的稳定性
C.最高价氧化物的水化物酸性强弱 D.将M的单质通入Z的钠盐溶液观察是否有Z逸出
(5)常温下,4.6gX单质在空中燃烧,再恢复到常温,放出QkJ能量,该反应的热化学方程式为_______________。
(6)W能形成多种氢化物,其中-种氢化物可作为火箭燃料,该物质中W与氢元素的质量比为7:1,写出该氢化物的电子式___________。该氢化物和O2在碱性条件下可形成燃料电池,产生两种无毒物质,写出其负极的电极反应式____________。
(7)Y元素和W元素形成的化合物YW一种新型无机材料,可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,写出有关的化学方程式___________________。