题目内容
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | ||||||||||||||||
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d在空气中燃烧产物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子.
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: .
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.此配合离子空间构型为 ,请写出生成此配合离子的离子方程式: .
(4)f(NH3)5BrSO4可形成两种配合物,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
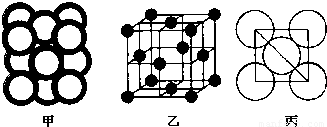
(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
c单质晶体中原子的配位数为 .若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M.该晶体的密度为 (用字母表示).
【答案】分析:由元素在周期表中的位置可知,a为N、b为F、c为Al、d为S、e为Cl、f为Co、g为Cu,
(1)NH3分子是三角锥形,中心原子N原子成3个N-Hσ键、含有1对孤对电子,杂化轨道数为4,据此判断杂化方式;
S在空气中燃烧产物生成SO2,对于ABn型分子,中心原子A原子的最外层电子全部成键,空间结构为平面正三角形,中心原子A原子的最外层电子未全部成键,空间结构为V形;
计算S原子的价层电子对,据此判断杂化方式;
对于ABn型分子,A原子的最外层电子全部成键,该分子是非极性分子,据此判断SO2分子极性;
(2)HF分子间形成氢键,HCl、H2S分子间没有氢键,HF沸点最高;
(3)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形;
(4)Co(NH3)5BrSO4可形成两种配合物,Co3+的配位数是6,在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,该物质可以电离出SO42-,故配体为NH3、Br-,该物质结构为[Co(NH3)5Br]SO4,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,该物质不能电离出SO42-,故配体为NH3、SO42-,该物质为[Co(NH3)5SO4]Br;
(5)由图可知,Al晶胞为面心立方堆积,配位数为12,由图丙可知,正方形的对角线长度为4r,故立方体的棱长为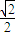 ×4r=2
×4r=2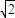 r,故晶胞体积为(2
r,故晶胞体积为(2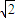 r)3=16
r)3=16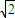 r3,晶胞中Al原子数目为6×
r3,晶胞中Al原子数目为6× +8×
+8× =4,利用ρV=
=4,利用ρV=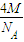 计算.
计算.
解答:解:由元素在周期表中的位置可知,a为N、b为F、c为Al、d为S、e为Cl、f为Co、g为Cu,
(1)NH3分子是三角锥形,中心原子N原子成3个N-Hσ键、含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;
S在空气中燃烧产物生成SO2,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,故SO2分子空间结构为V形,S原子的价层电子对2+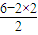 =3,故为S原子采取sp2杂化,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,SO2为极性分子,
=3,故为S原子采取sp2杂化,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,SO2为极性分子,
故答案为:三角锥形;sp3;V形;sp2;极性;
(2)HF分子间形成氢键,HCl、H2S分子间没有氢键,所以HF沸点最高,故答案为:HF;HF分子间形成氢键,HCl、H2S分子间没有氢键;
(3)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,该络合离子为平面正方形,
故答案为:平面正方形;Cu2++4H2O=[Cu(H2O)4]2+;
(4)Co(NH3)5BrSO4可形成两种配合物,Co3+的配位数是6,在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,该物质可以电离出SO42-,故配体为NH3、Br-,该物质结构为[Co(NH3)5Br]SO4,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,该物质不能电离出SO42-,故配体为NH3、SO42-,该物质为[Co(NH3)5SO4]Br,
故答案为:[Co(NH3)5SO4]Br;NH3、SO42-;
(5)由图可知,Al晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子处在12个面上,故配位数为12;
由图丙可知,正方形的对角线长度为4r,故立方体的棱长为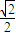 ×4r=2
×4r=2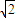 r,故晶胞体积为(2
r,故晶胞体积为(2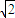 r)3=16
r)3=16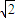 r3,晶胞中Al原子数目为6×
r3,晶胞中Al原子数目为6× +8×
+8× =4,由ρV=
=4,由ρV=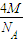 可知,ρ=
可知,ρ=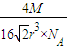 =
=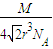 ,
,
故答案为:12;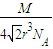 .
.
点评:本题考查元素周期表的结构、元素周期律、分子结构与性质、晶胞计算等,综合性较大,难度中等,是对知识的综合运用,(4)中注意配体形成配离子,不能电离出,(5)中注意根据均摊法计算晶胞的质量.
(1)NH3分子是三角锥形,中心原子N原子成3个N-Hσ键、含有1对孤对电子,杂化轨道数为4,据此判断杂化方式;
S在空气中燃烧产物生成SO2,对于ABn型分子,中心原子A原子的最外层电子全部成键,空间结构为平面正三角形,中心原子A原子的最外层电子未全部成键,空间结构为V形;
计算S原子的价层电子对,据此判断杂化方式;
对于ABn型分子,A原子的最外层电子全部成键,该分子是非极性分子,据此判断SO2分子极性;
(2)HF分子间形成氢键,HCl、H2S分子间没有氢键,HF沸点最高;
(3)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形;
(4)Co(NH3)5BrSO4可形成两种配合物,Co3+的配位数是6,在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,该物质可以电离出SO42-,故配体为NH3、Br-,该物质结构为[Co(NH3)5Br]SO4,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,该物质不能电离出SO42-,故配体为NH3、SO42-,该物质为[Co(NH3)5SO4]Br;
(5)由图可知,Al晶胞为面心立方堆积,配位数为12,由图丙可知,正方形的对角线长度为4r,故立方体的棱长为
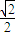 ×4r=2
×4r=2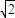 r,故晶胞体积为(2
r,故晶胞体积为(2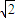 r)3=16
r)3=16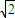 r3,晶胞中Al原子数目为6×
r3,晶胞中Al原子数目为6× +8×
+8× =4,利用ρV=
=4,利用ρV=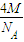 计算.
计算.解答:解:由元素在周期表中的位置可知,a为N、b为F、c为Al、d为S、e为Cl、f为Co、g为Cu,
(1)NH3分子是三角锥形,中心原子N原子成3个N-Hσ键、含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;
S在空气中燃烧产物生成SO2,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,故SO2分子空间结构为V形,S原子的价层电子对2+
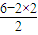 =3,故为S原子采取sp2杂化,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,SO2为极性分子,
=3,故为S原子采取sp2杂化,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,SO2为极性分子,故答案为:三角锥形;sp3;V形;sp2;极性;
(2)HF分子间形成氢键,HCl、H2S分子间没有氢键,所以HF沸点最高,故答案为:HF;HF分子间形成氢键,HCl、H2S分子间没有氢键;
(3)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,该络合离子为平面正方形,
故答案为:平面正方形;Cu2++4H2O=[Cu(H2O)4]2+;
(4)Co(NH3)5BrSO4可形成两种配合物,Co3+的配位数是6,在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,该物质可以电离出SO42-,故配体为NH3、Br-,该物质结构为[Co(NH3)5Br]SO4,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,该物质不能电离出SO42-,故配体为NH3、SO42-,该物质为[Co(NH3)5SO4]Br,
故答案为:[Co(NH3)5SO4]Br;NH3、SO42-;
(5)由图可知,Al晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子处在12个面上,故配位数为12;
由图丙可知,正方形的对角线长度为4r,故立方体的棱长为
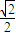 ×4r=2
×4r=2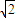 r,故晶胞体积为(2
r,故晶胞体积为(2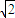 r)3=16
r)3=16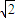 r3,晶胞中Al原子数目为6×
r3,晶胞中Al原子数目为6× +8×
+8× =4,由ρV=
=4,由ρV=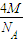 可知,ρ=
可知,ρ=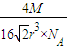 =
=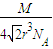 ,
,故答案为:12;
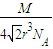 .
.点评:本题考查元素周期表的结构、元素周期律、分子结构与性质、晶胞计算等,综合性较大,难度中等,是对知识的综合运用,(4)中注意配体形成配离子,不能电离出,(5)中注意根据均摊法计算晶胞的质量.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是