题目内容
短周期主族元素A、B、C、D、E、的原子序数依次增大,A和B形成5个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子。D的原子半径最大,A、B、D、E与C形成的化合物均有两种,其中E与C形成的化合物中的一种能使品红溶液褪色。
则由A、B、C三种元素组成的中学常见的化合物中:
①甲燃烧则其耗氧量与乙烯相同则甲的结构简式是 。
②若乙能发生银镜反应则乙的化学式或结构简式是 。
③若丙分子中的B、A、C最简个数比为1:2: 1且丙能与D发生反应,则丙的结构简式
④若丁标况下蒸汽密度为3.93g/L,B%=54.5%,A%=9.1%,且丁能发生水解反应则丁的结构简式为 。
⑤若戊在同条件下密度为H2的22倍,4.4g该物质完全燃烧产物依次通过浓硫酸增重3.6g,碱石灰增重8.8g则戊的结构简式为 。
①CH3CH2OH ②CH2OH(CHOH)4CHO、CH3CHO ③CH3COOH
④CH3COOHCH2CH3、CH3CH2COOCH3、HCOOCH2CH2CH3、HCOOCH(CH3) ⑤CH3CHO
【解析】常见5核10电子分子是甲烷,3核10电子的分子是水分子,所以A是H,B是C,C是O。短周期中原子半径增大的是钠,则D是Na。E与O形成的化合物中的一种能使品红溶液褪色,该化合物应该是SO2,所以E是硫元素。
①乙烯的分子式为C2H4,所以燃烧时耗氧量与乙烯相同的应该是乙醇,因为乙醇的分子式看作是C2H4·H2O,,乙醇的结构简式为CH3CH2OH。
②能发生银镜反应,说明含有醛基,因此乙可以是葡萄糖或乙醛,结构简式分别为
CH2OH(CHOH)4CHO、CH3CHO。
③丙分子中的B、A、C最简个数比为1:2: 1,则最简式是CH2O。又因为丙能与钠发生反应,所以丙是乙酸,结构简式为CH3COOH。
④标况下蒸汽密度为3.93g/L,所以相对分子质量是3.93×22.4=88。所以碳和氢的原子个数分别是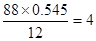 、
、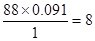 。因此氧原子的个数是
。因此氧原子的个数是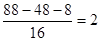 ,所以分子式为C4H8O2。又因为丁能发生水解反,所以丁可以是乙酸乙酯、丙酸甲酯或甲酸丙酯等。
,所以分子式为C4H8O2。又因为丁能发生水解反,所以丁可以是乙酸乙酯、丙酸甲酯或甲酸丙酯等。
⑤戊在同条件下密度为H2的22倍,所以相对分子质量是22×2=44,所以4.4g戊是0.1mol。燃烧产物依次通过浓硫酸增重3.6g,碱石灰增重8.8g,则水是3.6g,物质的量是0.2mol。CO2是8.8g,物质的量是0.2mol。所以分子中碳、氢原子的个数分别是4和2,因此氧原子的个数是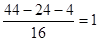 ,所以分子式为C2H4O,因此是乙醛
,所以分子式为C2H4O,因此是乙醛

| A、原子半径:A<D<C<B | B、B、C、D分别与A形成的化合物一定含有相同的化学键 | C、最高价氧化物对应水化物的酸性:D<C | D、常温下,单质B能大量溶于浓硝酸中 |
| A、原于半径A<B<C | B、A的气态氢化物稳定性大于C的气态氢化物稳定性 | C、A、C两元素最高价氧化物均可与水化合得到对应的酸 | D、高温时,A单质可以从C的氧化物中置换得到C单质 |
| A、原子半径由小到大的顺序:r(C)<r(D)<r(E) | B、元素D、E分别与A形成的化合物的热稳定性:E>D | C、元素D的最高价氧化物对应水化物的酸性比E的强 | D、元素B分别与A、C形成的化合物中化学键的类型完全相同 |
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物. NH3?H2O+H+
NH3?H2O+H+ 2NO2
2NO2