题目内容
(2011?石景山区一模)短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
(1)已知相关物质之间存在如下变化:
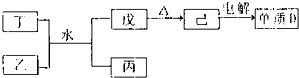
①丁与乙和水反应生成戊和丙的离子方程式为
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为
(2)已知E及其化合物有以下变化:
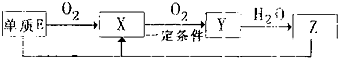
写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是
(1)已知相关物质之间存在如下变化:

①丁与乙和水反应生成戊和丙的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
,由物质己电解得到单质D的化学方程式为2Al2O3
4Al+3O2↑;
| ||
2Al2O3
4Al+3O2↑;
;
| ||
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为
C(NO3-)>C(NH4+)>C(H+)>C(OH-)
C(NO3-)>C(NH4+)>C(H+)>C(OH-)
;常温下,为使丙溶液中由丙电离的阴、阳离子浓度相等,应向溶液中加入一定量的乙的水溶液至溶液PH=7
溶液PH=7
.(2)已知E及其化合物有以下变化:

写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式
S+2H2SO4(浓)
3SO2↑+2H2O
| ||
S+2H2SO4(浓)
3SO2↑+2H2O
_,由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为
| ||
C2H6或N2H4
C2H6或N2H4
(任写一个即可).(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是
NaNO2
NaNO2
.分析:A元素的单质常温常压下是最轻的气体,说明A为H元素;B元素所形成化合物种类最多说明B为C元素,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙,说明C是N元素,丙是硝酸铵,D元素的离子半径是同周期元素形成的简单离子中最小的.结合转化关系可知,D为Al;E为S;
(1)转化关系中己为Al2O3,戊为Al(OH)3,丙为NH4NO3,丁+乙+H2O→Al(OH)3+NH4NO3;说明乙丁为NH3和铝盐;
①丁与乙和水反应生成戊和丙的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;物质己为Al2O3电解得到单质D为Al的化学方程式为:2Al2O3
4Al+3O2↑;
②0.1mol/L的丙溶液是NH4NO3中,铵根离子水解呈酸性,所含离子浓度由大到小排列顺序为:C(NO3-)>C(NH4+)>C(H+)>C(OH-);常温下,为使丙溶液硝酸铵溶液中电离的阴、阳离子浓度相等,依据溶液中电荷守恒分析判断;氢氧根离子浓度等于氢离子浓度,所以溶液至中性时C(NO3-)═C(NH4+),所以应向溶液中加入一定量的乙的水溶液至中性;
(2)依据转化关系判断:E为S;X为SO2;Y为SO3;Z为H2SO4;单质E为S,与化合物Z为浓H2SO4在一定条件下反,应生成X为SO2和水,反应化学方程为:S+2H2SO4(浓)
3SO2↑+2H2O;
由A、B、C、D、E5种元素分别为:H、C、N、Al、S;其中的两种元素可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为:C2H6、或N2H4;
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,证明无色气体为NO,红棕色气体为NO2;在一定条件下,2L的该无色气体与0.5L的氧气相混合,一氧化氮剩余1L,生成二氧化氮体积1L,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生的反应为NO+NO2+2NaOH=2NaNO2+H2O,所以生成的氮元素的含氧酸盐的化学式为:NaNO2;
(1)转化关系中己为Al2O3,戊为Al(OH)3,丙为NH4NO3,丁+乙+H2O→Al(OH)3+NH4NO3;说明乙丁为NH3和铝盐;
①丁与乙和水反应生成戊和丙的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;物质己为Al2O3电解得到单质D为Al的化学方程式为:2Al2O3
| ||
②0.1mol/L的丙溶液是NH4NO3中,铵根离子水解呈酸性,所含离子浓度由大到小排列顺序为:C(NO3-)>C(NH4+)>C(H+)>C(OH-);常温下,为使丙溶液硝酸铵溶液中电离的阴、阳离子浓度相等,依据溶液中电荷守恒分析判断;氢氧根离子浓度等于氢离子浓度,所以溶液至中性时C(NO3-)═C(NH4+),所以应向溶液中加入一定量的乙的水溶液至中性;
(2)依据转化关系判断:E为S;X为SO2;Y为SO3;Z为H2SO4;单质E为S,与化合物Z为浓H2SO4在一定条件下反,应生成X为SO2和水,反应化学方程为:S+2H2SO4(浓)
| ||
由A、B、C、D、E5种元素分别为:H、C、N、Al、S;其中的两种元素可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为:C2H6、或N2H4;
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,证明无色气体为NO,红棕色气体为NO2;在一定条件下,2L的该无色气体与0.5L的氧气相混合,一氧化氮剩余1L,生成二氧化氮体积1L,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生的反应为NO+NO2+2NaOH=2NaNO2+H2O,所以生成的氮元素的含氧酸盐的化学式为:NaNO2;
解答:A元素的单质常温常压下是最轻的气体,说明A为H元素;B元素所形成化合物种类最多说明B为C元素,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙,说明C是N元素,丙是硝酸铵,D元素的离子半径是同周期元素形成的简单离子中最小的.结合转化关系可知,D为Al;E为S;
(1)转化关系中己为Al2O3,戊为Al(OH)3,丙为NH4NO3,丁+乙+H2O→Al(OH)3+NH4NO3;说明乙丁为NH3和铝盐;
①丁与乙和水反应生成戊和丙的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;物质己为Al2O3电解得到单质D为Al的化学方程式为:2Al2O3
4Al+3O2↑;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3
4Al+3O2↑;
②0.1mol/L的丙溶液是NH4NO3中,铵根离子水解呈酸性,所含离子浓度由大到小排列顺序为:C(NO3-)>C(NH4+)>C(H+)>C(OH-);常温下,为使丙溶液硝酸铵溶液中电离的阴、阳离子浓度相等,依据溶液中电荷守恒分析判断;氢氧根离子浓度等于氢离子浓度,所以溶液至中性时C(NO3-)═C(NH4+),所以应向溶液中加入一定量的乙的水溶液至中性;
故答案为:C(NO3-)>C(NH4+)>C(H+)>C(OH-);溶液PH=7;
(2)依据转化关系判断:E为S;X为SO2;Y为SO3;Z为H2SO4;单质E为S,与化合物Z为浓H2SO4在一定条件下反,应生成X为SO2和水,反应化学方程为:S+2H2SO4(浓)
3SO2↑+2H2O;
由A、B、C、D、E5种元素分别为:H、C、N、Al、S;其中的两种元素可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为:C2H6、或N2H4;
故D答案为:C2H6或N2H4;
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,证明无色气体为NO,红棕色气体为NO2;在一定条件下,2L的该无色气体与0.5L的氧气相混合,一氧化氮剩余1L,生成二氧化氮体积1L,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生的反应为NO+NO2+2NaOH=2NaNO2+H2O,所以生成的氮元素的含氧酸盐的化学式为:NaNO2;
故答案为:NaNO2;
(1)转化关系中己为Al2O3,戊为Al(OH)3,丙为NH4NO3,丁+乙+H2O→Al(OH)3+NH4NO3;说明乙丁为NH3和铝盐;
①丁与乙和水反应生成戊和丙的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;物质己为Al2O3电解得到单质D为Al的化学方程式为:2Al2O3
| ||
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3
| ||
②0.1mol/L的丙溶液是NH4NO3中,铵根离子水解呈酸性,所含离子浓度由大到小排列顺序为:C(NO3-)>C(NH4+)>C(H+)>C(OH-);常温下,为使丙溶液硝酸铵溶液中电离的阴、阳离子浓度相等,依据溶液中电荷守恒分析判断;氢氧根离子浓度等于氢离子浓度,所以溶液至中性时C(NO3-)═C(NH4+),所以应向溶液中加入一定量的乙的水溶液至中性;
故答案为:C(NO3-)>C(NH4+)>C(H+)>C(OH-);溶液PH=7;
(2)依据转化关系判断:E为S;X为SO2;Y为SO3;Z为H2SO4;单质E为S,与化合物Z为浓H2SO4在一定条件下反,应生成X为SO2和水,反应化学方程为:S+2H2SO4(浓)
| ||
由A、B、C、D、E5种元素分别为:H、C、N、Al、S;其中的两种元素可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为:C2H6、或N2H4;
故D答案为:C2H6或N2H4;
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,证明无色气体为NO,红棕色气体为NO2;在一定条件下,2L的该无色气体与0.5L的氧气相混合,一氧化氮剩余1L,生成二氧化氮体积1L,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生的反应为NO+NO2+2NaOH=2NaNO2+H2O,所以生成的氮元素的含氧酸盐的化学式为:NaNO2;
故答案为:NaNO2;
点评:本题考查了元素判断和物质推断的方法,转化关系的应用,主要考查原子结构和元素推断,物质性质的判断,电解冶炼铝的原理,溶液中电荷守恒、离子浓度大小的比较等.

练习册系列答案
相关题目

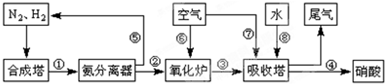
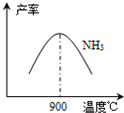 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因