题目内容
(12分)为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?________________;理由是_______________________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:________________________________。
方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?________________;理由是_______________________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:________________________________。
(1){(0.1C1V1—C2V2)/2M}X100%
(2)应该在干燥器中冷却;防止生成的CaO与空气中的CO2、H2O反应,造成误差
(3)因钙离子最后全变成了沉淀,所以只需M、M1即可
(4)C
(5)称取CaCO3样品M g ,加入过量的盐酸,收集并测定标准状况下生成的气体的体积V mL
(2)应该在干燥器中冷却;防止生成的CaO与空气中的CO2、H2O反应,造成误差
(3)因钙离子最后全变成了沉淀,所以只需M、M1即可
(4)C
(5)称取CaCO3样品M g ,加入过量的盐酸,收集并测定标准状况下生成的气体的体积V mL
(1)碳酸钙与盐酸反应后剩余盐酸的十分之一被氢氧化钠溶液中和,则与碳酸钙反应的盐酸为C1V1×10-3—10C2V2×10-3,则碳酸钙物质的量为0.5(C1V1×10-3—10C2V2×10-3),所以碳酸钙纯度为{(0.1C1V1—C2V2)/2M}X100%
(2)因CaO会与空气发生反应,所以放在干燥器中冷却;防止生成的CaO与空气中的CO2、H2O反应,造成误差
(3)A、B
(4)C
(5)称取CaCO3样品M g ,加入过量的盐酸,收集并测定标准状况下生成的气体的体积V mL
(2)因CaO会与空气发生反应,所以放在干燥器中冷却;防止生成的CaO与空气中的CO2、H2O反应,造成误差
(3)A、B
(4)C
(5)称取CaCO3样品M g ,加入过量的盐酸,收集并测定标准状况下生成的气体的体积V mL

练习册系列答案
相关题目
 CO
CO CO2
CO2 Na2CO3
Na2CO3 Cu(NO3)2溶液
Cu(NO3)2溶液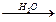 Ca(OH)2溶液
Ca(OH)2溶液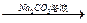 NaOH溶液
NaOH溶液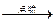 Fe2O3
Fe2O3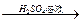 Fe2(SO4)3
Fe2(SO4)3
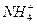 、Na+等离子的七种溶液一次性鉴别开来的试剂是( )
、Na+等离子的七种溶液一次性鉴别开来的试剂是( )