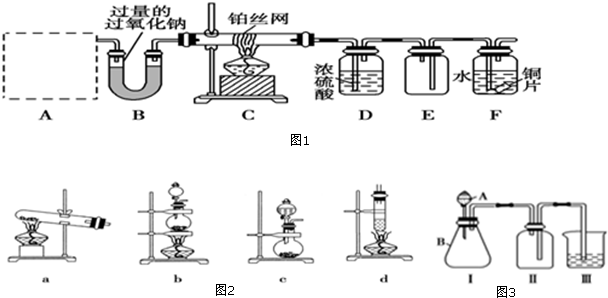
题目内容
16.下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )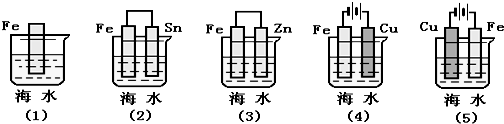
| A. | (2)(3)(4)(5)(1) | B. | (4)(3)(2)(5)(1) | C. | (5)(2)(1)(3)(4) | D. | (5)(3)(1)(2)(4) |
分析 先判断装置是原电池还是电解池,再根据原电池正负极腐蚀的快慢比较,作原电池负极和电解池阳极的金属易被腐蚀,作原电池正极或电解池阴极的金属易被保护,金属腐蚀快慢顺序是:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,(2)(3)装置是原电池,在(2)中,金属铁做负极,(3)中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,并且原电池原理引起的腐蚀>化学腐蚀,所以(2)>(3),
(4)(5)装置是电解池,(4)中金属铁为阴极,(5)中金属铁为阳极,阳极金属被腐蚀速率快,阴极被保护,即(5)>(4),
根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,
所以铁腐蚀快慢顺序为:(5)>(2)>(1)>(3)>(4);
故选:C.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道作原电池负极或电解池阳极的金属易被腐蚀,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.关于氧化物Na2O2和Na2O,它们( )
| A. | 阴阳离子个数比均为1:2 | B. | 都含有非极性共价键 | ||
| C. | 都与水发生氧化还原反应 | D. | 都属于碱性氧化物 |
1.人体血液的pH保持在7.35~7.45,适量的C02可以维持这个pH变化范围,可用下面化学方程式表示:H2O+C02?H2CO3?H++HCO3--,又知人体呼出的气体中C02的体积分数约5%,下列说法正确的是( )
| A. | 太快而且太深的呼吸可导致碱中毒 | B. | 太快而且太深的呼吸可导致酸中毒 | ||
| C. | 太浅的呼吸可导致碱中毒 | D. | 太浅的呼吸可导致体内pH升高 |
5.下列说法错误的是( )
| A. | 铜晶体的堆积方式为面心立方最密堆积 | |
| B. | H2O很稳定是因为水中有氢键 | |
| C. | 氯化钠熔化破坏了离子键 | |
| D. | 12g金刚石中含有的碳碳键数目为2 NA |
6.下列物质的反应可以用离子方程式H++OH-═H2O表示的是( )
| A. | 醋酸和氢氧化钠 | B. | 盐酸和氢氧化铜 | C. | 硫酸和氢氧化钡 | D. | 硫酸和氢氧化钾 |
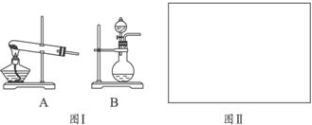
 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.