题目内容
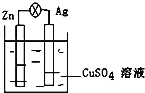
【题目】(1)锌电池有望代替铅蓄电池,它的构成材料是锌、空气某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是(写名称)____________;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是__________。
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下所示,该燃料电池工作时,外电路中电子的流动方向是从电极________到电极________(填“1”或“2”),电池的总反应为________。
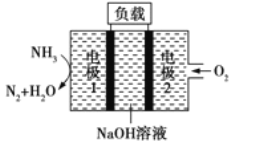
【答案】 锌 5.6L 1 2 4NH3+3O2=2N2+6H2O
【解析】(1)Zn失去电子,发生氧化反应,作原电池负极,O2得到电子发生还原反应,作原电池正极;每消耗1molO2转移4mole-,当导线中通过1mole-时,消耗0.25molO2;
②燃料电池工作时,还原性气体NH3在电极1失电子,发生氧化反应,所以电极1为负极,O2在电极2得电子,发生还原反应,所以电极2为正极,电池总反应为:4NH3+3O2=2N2+6H2O。以此解答。
(1)Zn失去电子,发生氧化反应,作原电池负极,O2得到电子发生还原反应,作原电池正极;每消耗1molO2转移4mole-,当导线中通过1mole-时,消耗0.25molO2,在标准状况下的体积为:0.25mol×22.4L/mol=5.6L。
因此,本题答案为:锌 ;5.6L;
②燃料电池工作时,还原性气体NH3在电极1失电子,发生氧化反应,所以电极1为负极,电极反应式为:2NH3+6OH—6e-=N2+6H2O;电子从电极1经外电路到电极2,O2在电极2得电子,发生还原反应,所以电极2为正极,电极反应式为:O2+4e-+2H2O=4OH-,电池总反应为:4NH3+3O2=2N2+6H2O。
因此,本题答案为:1 ,2;; 4NH3+3O2=2N2+6H2O。

 名校课堂系列答案
名校课堂系列答案【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素。
B | C | D | ||
A | E |
请用化学用语回答下列问题:
(1)A、D、E元素简单离子半径由大到小的顺序为 > > (填粒子符号)_____
(2)F与D同主族且相邻二者气态氢化物稳定性的大小关系为 > (填粒子符号)_________
(3)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放出一个电子,同时产生一种
具有较强氧化性的阳离子,试写出该阳离子的电子式:______________。该阳离子中存在的化学键有_________。
(4)由C、E两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子中C、E两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。写出甲遇水蒸气的化学方程式__________。
【题目】在生物实验中,可以根据与某些化学试剂所产生的颜色反应,检测生物组织中的有关有机化合物的存在。在下列实验列表中,正确的是( )
选项 | 待检测的物质 | 使用试剂 | 呈现颜色 |
A | 苹果中的还原糖 | 斐林试剂 | 橘黄色 |
B | 马铃薯中的淀粉 | 双缩脲试剂 | 蓝色 |
C | 花生的脂肪 | 苏丹Ⅲ染液 | 橘黄色 |
D | 大豆中的蛋白质 | 斐林试剂 | 紫色 |
A. A B. B C. C D. D