��Ŀ����
����Ŀ��ͭ�Ļ������кܶ࣬����Cu2S��Cu2O��CuCl������;�dz��㷺��һ��ͭ�Ļ�����ش��������⣺
(1)��֪��2Cu(s)+O2(g)=2CuO(s) ��H1=��314 kJmol-1
4CuO(s)=2 Cu2O(s)+ O2(g) ��H2=+292 kJmol-1
���෨�Ʊ�Cu2O�ķ�ӦCuO(s)+ Cu(s)=Cu2O(s)����H=________
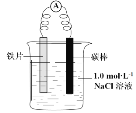
(2)��ͭ��(��Ҫ�ɷ�ΪCu2S)����ұ�������Ƶ�Cu��H2SO4����������ͼ��ʾ�����У���ⷨ������ͭ(������Ag��Fe)��CuSO4��Һ���������Һ��
�� ��ͭӦ��ֱ����Դ��_____ ��(���������� ������)������
�� ͭ������������������������ʽ���ڵ������Һ���ԭ����________ ��
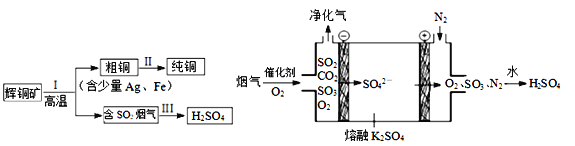
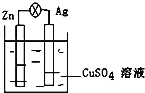
(3)���У�����(��Ҫ��SO2��CO2)�ڽϸ��¶Ⱦ�����ͼ��ʾ�����ѳ�SO2�����Ƶ�H2SO4������������SO3�ĵ缫��Ӧʽ��____________________________��
(4)��Ӧ2CuCl(s) + Hg22+(aq) ![]() Hg2Cl2(s) +2Cu+(aq)�ﵽƽ��ʱ��ƽ�ⳣ��K��_____(������λ��Ч����)������֪Ksp(CuCl)=1.2��10-6��Ksp (Hg2Cl2)=1.3��10-10��
Hg2Cl2(s) +2Cu+(aq)�ﵽƽ��ʱ��ƽ�ⳣ��K��_____(������λ��Ч����)������֪Ksp(CuCl)=1.2��10-6��Ksp (Hg2Cl2)=1.3��10-10��
���𰸡�-11 kJmol-1 �� Cu2���������Դ���Fe2���������� 2SO42- ��4e-= 2SO3 + O2 1.1��10��2
��������
(1)���ݸ�˹���ɷ������
(2)���ݵ��ԭ��������⾫��ͭ���������ϣ�������Һ�������ӵķŵ�˳��ش�
(3)����������ԭ��Ӧ����������������Ӧ����ʾ��ͼ��֪��������������õ��ӵõ�SO42-������������������������ʧȥ��������SO3��O2��
(4)��Ӧ2CuCl(s) + Hg22+(aq) ![]() Hg2Cl2(s) +2Cu+(aq)�ﵽƽ��ʱ��ƽ�ⳣ��K=
Hg2Cl2(s) +2Cu+(aq)�ﵽƽ��ʱ��ƽ�ⳣ��K=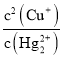 �����Ksp(CuCl)��Ksp (Hg2Cl2)���㡣
�����Ksp(CuCl)��Ksp (Hg2Cl2)���㡣
(1)��2Cu(s)+O2(g)=2CuO(s) ��H1=��314 kJmol-1����4CuO(s)=2 Cu2O(s)+ O2(g) ��H2=+292 kJmol-1�����ݸ�˹���ɣ�����+�ڵ�2CuO(s)+2Cu(s)=2Cu2O(s)��H=(��314 kJmol-1)+(+292 kJmol-1)=-22kJmol-1����CuO(s)+ Cu(s)=Cu2O(s) ��H=-11kJmol-1���ʴ�Ϊ��-11 kJmol-1��
(2)�ٵ�ⷨ��ͭʱ����������������Ӧ������������ԭ��Ӧ����������Ϊ��ͭ����ֱ����Դ�������������ʴ�Ϊ������
�ڴ�ͭ�е�����ԭ�Ա�ͭ��������Ӧ���Ե��ʵ���ʽ�����ڵ��������IJ۵ף�Fe��ԭ�Ա�ͭ��ǿ��ҲҪ�ŵ������������ӣ�����Cu2+�������Դ���Fe2+�������ԣ�����Һ�е�ͭ�����������ŵ������������������ڵ������Һ�У��ʴ�Ϊ��Cu2+�������Դ���Fe2+�������ԣ�
(3)����������ԭ��Ӧ����������������Ӧ����ʾ��ͼ��֪��������������õ��ӵõ�SO42-������������������������ʧȥ��������SO3��O2�������缫��Ӧ����ʽΪ��2SO42--4e-=2SO3��+O2�����ʴ�Ϊ��2SO42--4e-=2SO3��+O2����
(4)��Ӧ2CuCl(s) + Hg22+(aq) ![]() Hg2Cl2(s) +2Cu+(aq)�ﵽƽ��ʱ��ƽ�ⳣ��K=
Hg2Cl2(s) +2Cu+(aq)�ﵽƽ��ʱ��ƽ�ⳣ��K=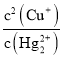 =
=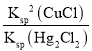 =
=![]() ��1.1��10��2���ʴ�Ϊ��1.1��10��2��
��1.1��10��2���ʴ�Ϊ��1.1��10��2��

 �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�����Ŀ��ijС��ͬѧ������ͼ��ʾװ�ý������ĵ绯ѧ��ʴԭ����̽��ʵ�飺
װ�� | �ֱ���еIJ��� | ���� |
| i. ����װ��һ��ʱ������ձ��еμӷ�̪ | |
ii. ����װ��һ��ʱ������ձ��еμ�K3[Fe(CN)6]��Һ | ��Ƭ���������ɫ���� |
(l)С��ͬѧ��Ϊ�������ּ��鷽��������֤���������˵绯ѧ��ʴ��
��ʵ��i�е�������____��
���û�ѧ�������ʵ��i�е�����____��
(2)�������ϣ�K3[Fe(CN)6]���������ԡ�
�پݴ���ͬѧ��Ϊ��ͨ��ii��������֤���������˵绯ѧ��ʴ�������� __________��
�ڽ�������ʵ�飬��ʵ�鼸���Ӻ�ļ�¼���£�
ʵ�� | �ι� | �Թ� | ���� |
| 0.5 mol��L-1 K3[Fe(CN)6]��Һ | iii. ����ˮ | �����Ա仯 |
iv. 1.0 mol��L-1 NaCl ��Һ | ��Ƭ�������������ɫ���� | ||
v. 0.5 mol��L-1 Na2SO4��Һ | �����Ա仯 |
a������ʵ���������____�����£�K3[Fe(CN)6]��Һ��������Ƭ������Ӧ��
b��Ϊ̽��Cl-�Ĵ��ڶԷ�Ӧ��Ӱ�죬С��ͬѧ����Ƭ��ϴ����ϡ������ݺ�ϴ�������ٽ���ʵ��iii��������Ƭ���������ɫ�������˲���ʵ�����Cl-��������____��
(3)��ͬѧ��Ϊ����ʵ���Բ��Ͻ���Ϊ��һ��̽��K3[Fe(CN)6]�������Զ�ʵ��ii�����Ӱ�죬������(2)��װ�ü���ʵ�顣������֤ʵ����Ӱ��ȷʵ���ڵ���____________������ĸ��ţ���
ʵ�� | �Լ� | ���� |
A | ��ϴ�����Ƭ��K3[Fe(CN)6]��Һ���ѳ�O2�� | ������ɫ���� |
B | ��ϴ�����Ƭ��K3[Fe(CN)6]��NaCl�����Һ��δ��O2�� | ������ɫ���� |
C | ��Ƭ��K3[Fe(CN)6]��NaCl�����Һ���ѳ�O2�� | ������ɫ���� |
D | ��Ƭ��K3[Fe(CN)6]����������Һ���ѳ�O2�� | ������ɫ���� |
�ۺ�����ʵ�����������ʵ��ii���Լ���֤ʵ�������˵绯ѧ��ʴ��ʵ�鷽���� _________��
����Ŀ���״���һ�����͵���������ȼ�ϡ���ش��������⣺
(1)��ҵ�Ͽ�ͨ��CO��H2�������Ʊ�CH3OH(g)����֪ijЩ��ѧ���ļ����������±���
��ѧ�� | C-C | C-H | H-H | C-O |
| H-O |
����/kJmol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
��֪��CO�е�C��O֮���γɵĻ�ѧ��Ϊ![]() ������ҵ�Ʊ��״����Ȼ�ѧ����ʽ__________________��
������ҵ�Ʊ��״����Ȼ�ѧ����ʽ__________________��
(2)���ݻ��̶�Ϊ2L���ܱ������ڳ���1molCO��2molH2��������ʵĴ���(������Ժ��Բ���)����250���¿�ʼ��Ӧ������ѹ���Ƽ��������ѹǿ�ı仯���£�
��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 |
ѹǿ/MPa | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
��ӷ�Ӧ��ʼ��20minʱ����CO��ʾ��ƽ����Ӧ����Ϊ___________�����¶���ƽ�ⳣ��K= ______���������¶ȣ���CO��ת����_______(��������������С������������)��
(3)�������ݻ���Ϊ1 L�ĺ����ܱ�������ֻ������Ӧ��2CH3OH(g) ![]() C2H4(g)+2H2O(g)�����ݱ��е�������ݿ�ȷ���÷�Ӧ����H______0(������������������=������ͬ)������C�ﵽƽ��ʱ����������ѹǿp(C)/p(A)_______2������A�ﵽƽ��ʱ�����������ٳ���CH3OH(g)��C2H4(g)��H2O(g)��0.1 mol����ʱ����(��)_______��(��)��
C2H4(g)+2H2O(g)�����ݱ��е�������ݿ�ȷ���÷�Ӧ����H______0(������������������=������ͬ)������C�ﵽƽ��ʱ����������ѹǿp(C)/p(A)_______2������A�ﵽƽ��ʱ�����������ٳ���CH3OH(g)��C2H4(g)��H2O(g)��0.1 mol����ʱ����(��)_______��(��)��
���� | �¶�/�� | ��ʼ������/mol | ƽ��ʱ��ϩ/mol | ||
CH3OH(g) | C2H4(g) | H2O(g) | |||
A | 310 | 0.2 | 0 | 0 | 0.05 |
B | 327 | 0 | 0.1 | 0.2 | 0.047 |
C | 310 | 0.2 | 0.1 | 0.2 | / |