题目内容
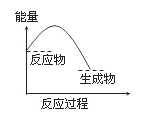
【题目】下列反应过程中能量变化的趋势与图一致的是( )
A. C + CO2![]() 2CO
2CO
B. CaCO3![]() CaO + CO2↑
CaO + CO2↑
C. 2Al + Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl==BaCl2 + 2NH3↑+ 10H2O
【答案】C
【解析】
由图可知,反应物的总能量高于生成物的总能量,反应为放热反应,
A. C + CO2![]() 2CO此反应为吸热反应,故A不符合;
2CO此反应为吸热反应,故A不符合;
B. CaCO3![]() CaO + CO2↑多数分解反应属于吸热反应,故B不符合;
CaO + CO2↑多数分解反应属于吸热反应,故B不符合;
C. 2Al + Fe2O3![]() 2Fe + Al2O3铝热反应是典型的放热反应,故C符合;
2Fe + Al2O3铝热反应是典型的放热反应,故C符合;
D. Ba(OH)2·8H2O + 2NH4Cl==BaCl2 + 2NH3↑+ 10H2O此反应为吸热反应,故D不符合,
故选C。

练习册系列答案
相关题目
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。