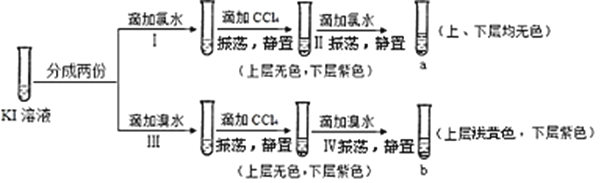
题目内容
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是___。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g)CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如图所示。
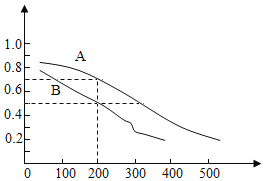
①生成甲醇的反应为___反应(填“放热”或“吸热”)。
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是___(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有___(答出一种即可)。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是___。
【答案】C(s)+CO2(g)=2CO(g) △H=+172.5 kJmol﹣1 放热 A 降温或加压 25%
【解析】
(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2kJmol﹣1,利用盖斯定律将①﹣②可得C(s)+CO2(g)=2CO(g)△H=+172.5 kJmol﹣1,故答案为:C(s)+CO2(g)=2CO(g)△H=+172.5 kJmol﹣1;
(2)①由图象可知,随温度的升高其转化率降低,说明升温时平衡逆向移动,正反应放热,故答案为:放热;
②从方程式可知,反应物有3mol气体,生成物有1mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在相同温度时,转化率高的压强大,故答案为:A;
③增大反应物的转化率,即要使平衡向正向移动,而影响平衡移动的因素只有三个:温度、压强、浓度,本题只能是降温或加压,故答案为:降温或加压;
④根据图像,压强为0.1MPa、温度为200℃时CO的转化率为50%,设加入CO物质的量为amol,则H2为2amol
CO(g)+2H2(g)CH3OH(g)
反应前(mol) a 2a 0
反应了(mol)0.5a a 0.5a
平衡时(mol)0.5a a 0.5a
求得平衡时甲醇的物质的量分数为:![]() ×100%=25%,故答案为:25%。
×100%=25%,故答案为:25%。

 名校课堂系列答案
名校课堂系列答案