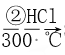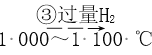题目内容
【题目】(1)25℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列为___________(填序数)。
(2)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显___________(填“酸”碱”或“中)性;用含a的代数式表示NH3·H2O的电离常数Kb=___________。
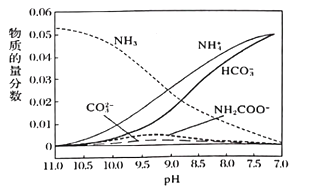
(3)一定温度下,向氨水中通入CO2,得到(NH4)2CO3、NH4HCO3等物质,溶液中各种微粒的物质的量分数与pH的关系如图所示。随着CO2的通入,溶液中c(OH-)/c(NH3·H2O)将___________(填“增大”“减小”或“不变”)。pH=9时,溶液中c(NH4+)+c(H+)=___________。
(4)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂,常用于葡萄酒、果脯等食品中。在测定某葡萄酒中Na2S2O5残留量时,取25.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗5.00mL。该滴定反应的离子方程式为___________;葡萄酒中的Na2S2O5的使用量是以SO2来计算的,则该样品中Na2S2O5的残留量为___________g·L-1。
【答案】④>①>②>③ 中 ![]() 减小 2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) S2O52-+2I2+3H2O===2SO42-+4I-+6H+ 0.128
减小 2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) S2O52-+2I2+3H2O===2SO42-+4I-+6H+ 0.128
【解析】
(1)根据根据影响水电离的因素进行判断;(2)根据电荷守恒进行判断;(3)根据电子守恒进行解答。
(1)根据影响水电离的因素可知:②NaOH、③H2SO4 抑制水的电离,且相同物质的量浓度的③H2SO4 抑制程度更大;④(NH4)2SO4能发生水解,促进水的电离;①NaCl对水的电离无影响,所以25℃时,相同物质的量浓度的溶液水的电离程度按由大到小顺序排列为④>①>②>③;答案:④>①>②>③;
(2)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),根据电荷守恒,c(H+)+c(NH4+)=c(Cl-)+ c(OH-)所以c(H+)=c(OH),则溶液显中性; 因为平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,因为溶液呈中性,所以c(H+)=c(OH)=10-7mol/L,NH3H2O的电离常数Kb= c(OH-).c(NH4+)/c((NH3.H2O)=107×5×103/(0.5a5×103)=109/(a0.01);答案:![]()
(3)c(OH-)/c((NH3.H2O)= c(OH-)×c(NH4+)/[c((NH3.H2O)×c(NH4+)]=Kb/c(NH4+),Kb不变,c(NH4+)不断增大,比值不断减小;根据电荷守恒,pH=9时,溶液中存在电荷守恒c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-);答案:减小; 2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-);
(4) I2作氧化剂,1molI2参与反应得到2mol电子,S2052-为还原剂,1molS2052-参与反应,硫元素失去4mol电子,根据原子守恒配平方程式: S2052-+212+3H20=2SO42-+4I-+6H+,计算祥品中S2052-的残留量时以SO2计算,n(I2)=n(SO2)=0.01000mol.L1x0.01L=0.0001mol,m(S02)=0.0064g,则该样品中Na2S2O5的残留量为0.0064g/0.05L =0.128g.L-1。答案:0.128。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案