题目内容
有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+?Fe3+[Fe(1-x)3+?Crx3+?O4].向含有1.92mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688L(标准状况).
计算:(均需写出计算过程):
①参加反应的铁氧体的物质的量.
②所得气体中NO、NO2的体积比.
计算:(均需写出计算过程):
①参加反应的铁氧体的物质的量.
②所得气体中NO、NO2的体积比.
考点:化学方程式的有关计算
专题:计算题
分析:①铁氧体与硝酸反应生成Fe(NO3)3、Cr(NO3)3,令参加反应的铁氧体为n mol,由Fe、Cr原子守恒,则Fe(NO3)3、Cr(NO3)3的总物质的量为3n mol,根据N元素守恒列方程计算;
②设生成NO为ymol,NO2为ymol,根据电子转移守恒与气体物质的量列方程,进而计算NO、NO2的体积.
②设生成NO为ymol,NO2为ymol,根据电子转移守恒与气体物质的量列方程,进而计算NO、NO2的体积.
解答:
解:①NO、NO2的混合气体2.688L,物质的量=
=0.12mol,铁氧体与硝酸反应生成Fe(NO3)3、Cr(NO3)3,令参加反应的铁氧体为n mol,则Fe(NO3)3、Cr(NO3)3的总物质的量=nmol+nmol+n(1-x)mol+xn mol=3n mol,由N元素守恒:3n mol×3+0.12mol=1.92mol,解得n=0.2,
答:参加反应的铁氧体的物质的量为0.2mol.
②反应亚铁离子失去电子,转移电子为0.2mol×(3-2)=0.2mol,
设生成NO为xmol,NO2为ymol,由转移电子及二者物质的量,则:
,
解得x=0.04 y=0.08,
故V(NO):V(NO2)=0.04mol:0.08mol=1:2;
答:所得气体中NO、NO2的体积比为1:2.
| 2.688L |
| 22.4L/mol |
答:参加反应的铁氧体的物质的量为0.2mol.
②反应亚铁离子失去电子,转移电子为0.2mol×(3-2)=0.2mol,
设生成NO为xmol,NO2为ymol,由转移电子及二者物质的量,则:
|
解得x=0.04 y=0.08,
故V(NO):V(NO2)=0.04mol:0.08mol=1:2;
答:所得气体中NO、NO2的体积比为1:2.
点评:本题以电子工业广泛应用的含铬铁氧体为载体,考查混合物的有关计算,难度中等,注意根据元素守恒与电子转移守恒进行解答.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
下列说法不正确的是( )
| A、在医疗上,碳酸氢钠是治疗胃酸过多症的一种药剂 |
| B、工业上生产漂粉精,是通过氯气与石灰水作用制成的 |
| C、高性能通信材料光导纤维的主要原料是二氧化硅 |
| D、空气中的NO2是造成光化学烟雾的主要因素 |
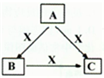 A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(其它产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(其它产物已略去),下列说法错误的是( )| A、若X为O2,则A可为硫化氢 |
| B、若X为KOH溶液,则A可能为AlCl3 |
| C、若X为Fe,则C可能为Fe(NO3)2 |
| D、若A、B、C均为焰色反应呈黄色的化合物,则X可能为Na |
下列说法正确的是( )
| A、Na2SO3与BaCl2溶液作用,有白色沉淀,加稀硝酸后沉淀消失 |
| B、将SO2气体通入Ba(OH)2溶液中没有白色沉淀生成 |
| C、将SO2气体通过BaCl2溶液中有白色沉淀生成 |
| D、将SO2气体通入用硝酸酸化的BaCl2溶液中有白色沉淀生成 |
科学家在《Science》上发表论文,宣布发现了铝的超原子结构Al13和Al14,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定到Al13-和Al142+.下列说法错误的是( )
| A、Al13和Al14互为同位素 |
| B、Al13超原子中Al原子间是通过共价键结合的 |
| C、Al13和Al的化学性质相似,都具有较强的还原性 |
| D、Al14和稀盐酸反应的化学方程式可表示为Al14+2HCl→Al14Cl2+H2↑ |
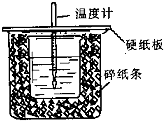 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如图,回答下列问题: