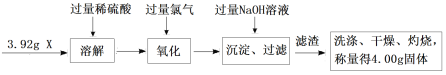
题目内容
【题目】乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH + SOCl2 → R-Cl + SO2 ↑+ HCl↑ 请回答:

(1)写出B的官能团的电子式________________________。
(2)写出有关物质的结构简式:A_________________D_________________。
(3)指出反应类型:②_________________。
(4)写出下列化学方程式:反应①______________;反应②___________。
(5)①二甘醇又名(二)乙二醇醚,根据其结构判断下列说法正确的是____(填序号)。
a. 难溶于水 b. 沸点较高 c. 不能燃烧
②E的同分异构体很多,写出其中能够发生银镜反应的两种异构体的结构简式_________________。
(6)请写出由1-氯丙烷合成丙酮的合成路线图并注明反应条件(无机试剂任选)________。合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
【答案】![]()
![]() Cl-CH2CH2-O-CH2CH2-Cl 消去反应
Cl-CH2CH2-O-CH2CH2-Cl 消去反应 ![]() ClCH2CH2OCH2CH2Cl + 2KOH
ClCH2CH2OCH2CH2Cl + 2KOH ![]() CH2=CH-O-CH=CH2 + 2KCl + 2H2O b CH2=CHCH2CHO、CH3CH=CHCHO或CH2=C(CH3)CHO
CH2=CH-O-CH=CH2 + 2KCl + 2H2O b CH2=CHCH2CHO、CH3CH=CHCHO或CH2=C(CH3)CHO 
【解析】
乙烯发生氧化反应生成A(C2H4O),A的结构中没有甲基,则A为![]() ,A在酸性条件下水解得到B,B的核磁共振氢谱有2种H,结合二甘醇的结构可知B为HOCH2CH2OH.二甘醇发生信息中的反应得到D,结合D的分子式可知D的结构简式为Cl-CH2CH2-O-CH2CH2-Cl,D发生消去反应生成E为CH2=CHOCH=CH2。
,A在酸性条件下水解得到B,B的核磁共振氢谱有2种H,结合二甘醇的结构可知B为HOCH2CH2OH.二甘醇发生信息中的反应得到D,结合D的分子式可知D的结构简式为Cl-CH2CH2-O-CH2CH2-Cl,D发生消去反应生成E为CH2=CHOCH=CH2。
(1)由上述分析可知,B为HOCH2CH2OH,官能团为羟基,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)由上述分析可知,A的结构简式为![]() ,D的结构简式为:Cl-CH2CH2-O-CH2CH2-Cl,故答案为:
,D的结构简式为:Cl-CH2CH2-O-CH2CH2-Cl,故答案为:![]() ;Cl-CH2CH2-O-CH2CH2-Cl;
;Cl-CH2CH2-O-CH2CH2-Cl;
(3)反应②为卤代烃在氢氧化钾醇溶液中的消去反应,故答案为:消去反应;
(3)反应①的化学方程式为:![]() ,反应②的化学方程式为:ClCH2CH2OCH2CH2Cl+2KOH
,反应②的化学方程式为:ClCH2CH2OCH2CH2Cl+2KOH![]() CH2=CH-O-CH=CH2+2KCl+2H2O,故答案为:
CH2=CH-O-CH=CH2+2KCl+2H2O,故答案为:![]() ;ClCH2CH2OCH2CH2Cl+2KOH
;ClCH2CH2OCH2CH2Cl+2KOH![]() CH2=CH-O-CH=CH2+2KCl+2H2O;
CH2=CH-O-CH=CH2+2KCl+2H2O;
(4)a.含有2个羟基,与水形成氢键,应易溶于水,故a错误;b.分子之间形成氢键,沸点较高,故b正确;c.属于烃的含氧衍生物,能燃烧,故c错误;故选:b;
(5)E为CH2=CHOCH=CH2,能够发生银镜反应的E的同分异构体的结构简式为CH2=CHCH2CHO、CH3CH=CHCHO、CH2=C(CH3)CHO,故答案为:CH2=CHCH2CHO、CH3CH=CHCHO、CH2=C(CH3)CHO;
(6)由1-氯丙烷合成丙酮,可以首先合成2-丙醇,然后将2-丙醇氧化即可得到丙酮,由1-氯丙烷合成2-丙醇,可以将氯原子消去,然后与水加成即可,合成路线为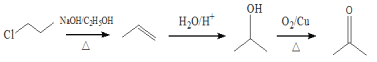 ,故答案为:
,故答案为: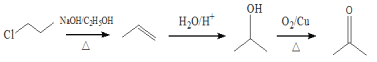 。
。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
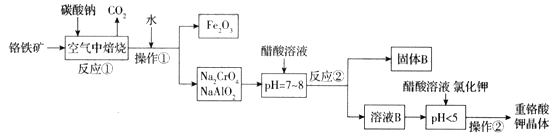
(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有__________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 | ( g / 100 g H2O ) | |
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①加入KCl固体后经一系列操作析出K2Cr2O7晶体的理由是___________________________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对人类生成环境有极大的危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3
【题目】根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
Ⅲ、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
Ⅳ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)AsCl3分子的立体构型为_____________,铁原子中有_________个未成对电子。
(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的原子是_____。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(6)某镍白铜合金的立方晶胞结构如图所示。
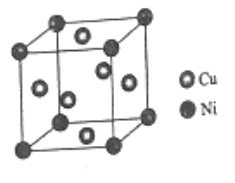
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm