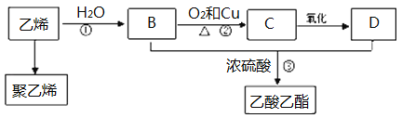
题目内容
【题目】根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
Ⅲ、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
Ⅳ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)AsCl3分子的立体构型为_____________,铁原子中有_________个未成对电子。
(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的原子是_____。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(6)某镍白铜合金的立方晶胞结构如图所示。
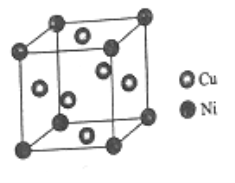
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
【答案】1s22s22p63s23p63d84s2或【Ar】3d84s2O>C>Hsp3和sp27:1三角锥形4配位键NGeCl4、GeBr4、GeI4熔沸点依次升高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强3:1![]()
【解析】
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式;3d能级上的未成对的电子数为2。(2)非金属性越强,电负性越强;乙酸分子中含有甲基碳原子和羧基碳原子,根据价层电子对互斥理论判断碳原子的轨道杂化类型;乙酸分子中单键为σ键,双键中含有1个σ键和1个π键,据此进行解答;(3)锗的卤化物都是分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高;(4)①该晶胞中Ni原子个数=8×1818=1、Cu原子个数=6×1212=3;②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=![]() 。
。
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;(2)CH3COOH分子中含有C、O、H元素,非金属性:O>C>H,则电负性:O>C>H;CH3COOH分子内含有甲基碳原子和羧基碳原子,甲基碳原子中形成4个σ键,为sp3杂化,羧基碳原子形成3个σ键,无孤对电子,杂化方式为sp2杂化;CH3COOH分子中含有3个C-H键、1个C-C键、1个O-H键、1个C-O单键及1个碳氧双键,单键为σ键,双键中含有1个σ键和1个π键,所以CH3COOH分子中含有7个σ键、1个π键,σ键与π键数目之比为7:1;(3)锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:GeCl4<GeBr4<GeI4,故沸点:GeCl4<GeBr4<GeI4;(4)①该晶胞中Ni原子个数=8×![]() =1、Cu原子个数=6×
=1、Cu原子个数=6×![]() =3,则Cu、Ni原子个数之比为3:1;②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=
=3,则Cu、Ni原子个数之比为3:1;②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=![]() 。
。

 快捷英语周周练系列答案
快捷英语周周练系列答案