题目内容
【题目】(1)写出COS的电子式__________________,C与O形成共价键时,共用电子对会偏向__________原子,判断依据是___________。
(2)已知COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/mol
CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-41kJ/mol
H2(g)+CO2(g) △H2=-41kJ/mol
写出H2S与CO反应生成COS的热化学方程式__________________________________。
100℃时将CO与H2S按物质的量比为1∶1充入反应器中,达平衡后CO的转化率α=33.3%,此时反应的平衡常数k=________________________。
(3)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
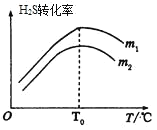
①m1________m2(填>、<或=)
②温度高于T0时,H2S转化率减小的可能原因为_________
a.反应停止了 b.反应的△H变大
c.反应达到平衡 d.催化剂活性降低
【答案】![]() O(氧) C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C CO(g)+H2S(g)
O(氧) C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C CO(g)+H2S(g)![]() COS(g)+H2(g)△H2=-7kJ/mol 0.25 > d
COS(g)+H2(g)△H2=-7kJ/mol 0.25 > d
【解析】
(1)根据共价键的相关知识解答;
(2) COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-34kJ/mol①,
H2S(g)+CO2(g) △H1=-34kJ/mol①,
CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-41kJ/mol②,
H2(g)+CO2(g) △H2=-41kJ/mol②,
运用盖斯定律CO(g)+H2S(g)![]() COS(g)+H2(g) △H,由②-①所得,计算可得;平衡常数,可用三段式进行计算;
COS(g)+H2(g) △H,由②-①所得,计算可得;平衡常数,可用三段式进行计算;
(3)①在充有催化剂的恒压密闭容器中只进行反应,设起始充入的n(CO)∶n(H2S)=m,m越大说明CO量越多,两种反应物增加一种会提高另一种的转化率;
②温度高于T0,H2S转化率减小是因为温度升高,催化剂活性减弱,反应减慢,平衡逆向进行,H2S转化率减小。
(1) COS的电子式![]() ;C与O形成共价键时,由于C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C,共用电子对会偏向氧原子,故答案为:
;C与O形成共价键时,由于C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C,共用电子对会偏向氧原子,故答案为:![]() ;O(氧);C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C;
;O(氧);C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C;
(2) COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-34kJ/mol①,
H2S(g)+CO2(g) △H1=-34kJ/mol①,
CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-41kJ/mol②,
H2(g)+CO2(g) △H2=-41kJ/mol②,
运用盖斯定律CO(g)+H2S(g)![]() COS(g)+H2(g) △H,由②-①所得△H=-41kJ/mol-(-34kJ/mol)= -7kJ/mol,故H2S与CO反应生成COS的热化学方程式为CO(g)+H2S(g)
COS(g)+H2(g) △H,由②-①所得△H=-41kJ/mol-(-34kJ/mol)= -7kJ/mol,故H2S与CO反应生成COS的热化学方程式为CO(g)+H2S(g)![]() COS(g)+H2(g) △H=-7kJ/mol;CO与H2S按物质的量比为1∶1充入反应器中,设CO与H2S的起始量各为3mol,达平衡后CO的转化率α=33.3%,可用三段式进行计算;
COS(g)+H2(g) △H=-7kJ/mol;CO与H2S按物质的量比为1∶1充入反应器中,设CO与H2S的起始量各为3mol,达平衡后CO的转化率α=33.3%,可用三段式进行计算;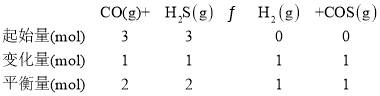 ,体积相同,则K=
,体积相同,则K=![]() ,故答案为:CO(g)+H2S(g)
,故答案为:CO(g)+H2S(g)![]() COS(g)+H2(g) △H=-7kJ/mol;0.25;
COS(g)+H2(g) △H=-7kJ/mol;0.25;
(3)①在充有催化剂的恒压密闭容器中只进行反应,设起始充入的n(CO)∶n(H2S)=m,m越大说明CO量越多,两种反应物增加一种会提高另一种的转化率,则m1>m2,故答案为:>;
②温度高于T0,H2S转化率减小是因为温度升高,催化剂活性减弱,反应减慢,平衡逆向进行,H2S转化率减小,可逆反应处于动态平衡,△H只与反应物和生成物的总能量有关,故答案为:d。