题目内容
某可逆反应平衡常数表达式为 。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
A.反应的热化学方程式为NO2(g)+SO2(g)  NO(g)+SO3(g) ΔH>0 NO(g)+SO3(g) ΔH>0 |
| B.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深 |
| C.混合气体的平均摩尔质量保持不变,说明反应已达平衡 |
| D.使用合适的催化剂可使该反应的反应速率和平衡常数增大 |
B
解析试题分析:A、升高温度c(NO)减小,说明平衡逆向移动,所以正反应是放热反应,ΔH<0,错误;B、增大体系压强就是缩小容器体积,平衡虽然不移动,但气体颜色仍然加深,正确;C、该反应前后气体的总质量和总物质的量都不会发生变化,因此混合气体的平均摩尔质量保持不变,但不能说明反应已达平衡,错误;D、使用催化剂可加快化学反应速率,但平衡常数不变,错误。
考点:考查化学反应速率和化学平衡问题,涉及影响因素、平衡常数等问题。

在密闭容器中的一定量混合气体发生反应: xA(g) + yB(g)  zC(g) ΔH>0,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时, 测得A的浓度为0.30mol/L。下列有关判断正确的是
zC(g) ΔH>0,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时, 测得A的浓度为0.30mol/L。下列有关判断正确的是
| A.x+y<z |
| B.B的转化率降低 |
| C.该反应的平衡常数变小 |
| D.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
在一定温度下,向容积不变的密闭容器中充入amolA,发生反应:2A(g) B(g);△H<0。达平衡后再向容器中充入amolA,再次达到平衡后,与原平衡比较,下列叙述不正确的是
| A.相对平均分子质量增大 |
| B.A的转化提高 |
C.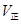 增大, 增大, 减小 减小 |
| D.反应放出的总热量大于原来的2倍 |
一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | | | |
| t2 | | 0.20 | | |
B.平衡时水蒸气的转化率为66.67%
C.该温度下反应的平衡常数为l
D.其他条件不变,若起始时,n(CO)="0.60" mol,n(H2O)="1.20" mol,则平衡时水蒸气的转化率为33.33%
盐酸与过量铁粉的反应,若有CH3COONa(s,适量)介入,则有
| A.反应速率减缓 | B.产生氢气的总量不变 |
| C.溶液的pH减小 | D.溶液中c(OH-)减小 |
某温度下,把3molA和2.5molB混合,盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气) xC(气)+2D(气)
xC(气)+2D(气)
经过5min后达到平衡生成1mol D , 测得C的平均生成速率为0.10mol·L-1·min-1。下列叙述不正确的是
| A.x的值为2 |
| B.B的转化率为20% |
| C.平衡常数为1/3 |
| D.A的平均消耗速率为0.15mol·L-1·min-1 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
下列叙述正确的是
| A.点a的正反应速率比点b的小 |
| B.点 c处反应达到平衡 |
| C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)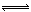 2SO3(g) △H<0,n(SO2)随时间的变化如表:
2SO3(g) △H<0,n(SO2)随时间的变化如表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4min内该反应的平均速率为0.005mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
| A.0~t2时,v正>v逆 |
| B.t2时刻改变的条件可能是加催化剂 |
| C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ |
| D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ |