题目内容
在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)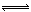 2SO3(g) △H<0,n(SO2)随时间的变化如表:
2SO3(g) △H<0,n(SO2)随时间的变化如表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4min内该反应的平均速率为0.005mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
D
解析试题分析:A、当v(SO2)=v(SO3)时,如果反应速率的方向一致,则根据反应速率之比是相应的化学计量数之比可知,该关系式是恒成立的,不能说明反应达到平衡状态,A不正确;B、根据表中数据可知,在0~4min内SO2的物质的量减少了0.20mol-0.08mol=0.12mol,其浓度是0.12mol÷2L=0.06mol/L,则根据方程式可知,氧气的浓度减少了0.03mol/L,所以用O2表示0~4min内该反应的平均速率为0.03mol/L÷4min=0.0075mol/(L·min),B不正确;C、正方应是放热反应,所以升高温度平衡向逆反应方向移动,因此若升高温度,则SO2的反应速率会变大,平衡常数K值会减小,C不正确;D、平衡时再通入O2,根据勒夏特列原理可知,平衡右移,O2转化率减小,SO2转化率增大,D正确,答案选D。
考点:考查平衡状态的判断、外界条件对反应速率和平衡状态的影响、反应速率和平衡常数的计算

 阅读快车系列答案
阅读快车系列答案溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是
HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是
| A.加压 | B.加入NaF晶体 | C.通入SO2气体 | D.加入NaI晶体 |
某可逆反应平衡常数表达式为 。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
A.反应的热化学方程式为NO2(g)+SO2(g)  NO(g)+SO3(g) ΔH>0 NO(g)+SO3(g) ΔH>0 |
| B.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深 |
| C.混合气体的平均摩尔质量保持不变,说明反应已达平衡 |
| D.使用合适的催化剂可使该反应的反应速率和平衡常数增大 |
两体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g) 3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 |
| B.正反应是吸热反应 |
| C.t3时刻可能是增大了压强 |
| D.t3时刻可能是降低了温度 |
下列图示与对应的叙述相符的是
A.图I可表示N2+3H2 2NH3的速率时间图像,t1时刻改变的条件是升高温度 2NH3的速率时间图像,t1时刻改变的条件是升高温度 |
| B.图Ⅱ可表示用0.1 000 mol/L醋酸滴定40.00 mL0.1000 mol/LNaOH溶液得到的滴定曲线 |
| C.图Ⅲ可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2 |
| D.图Ⅳ可表示pH相同的NaOH溶液与氨水稀释过程的pH变化.其中曲线a对应氨水 |
T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:
A(g)+2B (g)  C(g)
C(g)
反应过程中测定的部分数据见下表:
| 反应时间/min | n(A)/mol | n(B)/ mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | | 0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
下列叙述正确的是
| A.对于平衡体系:H2(g)+I2(g)==2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深 |
| B.—定温度下,物质的量浓度相同的4种溶液①CH3COONa②NaNO3③Na2CO3④NaOH,pH的大小顺序是④>③>①>② |
| C.0.1mol?L-1的氨水加水稀释后,NH3?H2O的电离程度增大,c(OH-)增大,c(H+)减小 |
| D.常温下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO-2-、NO3-可大量共存 |
下列图示与对应的叙述相符的是



甲 乙 丙 丁
A.图甲可以判断出反应A(g) + B(g) 2C(g) 的△H<0,T2>T1 2C(g) 的△H<0,T2>T1 |
B.图乙表示压强对可逆反应2A(g) + 2B(g) 3C(g) + D(s)的影响,乙的压强比甲的压强大 3C(g) + D(s)的影响,乙的压强比甲的压强大 |
| C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4 |
| D.图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化 |
将CO2转化为甲醇的原理为 CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
| A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 |
| B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) |
| C.平衡时H2的转化率为75% |
| D.500 ℃时该反应的平衡常数K=3 |