题目内容
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
下列叙述正确的是
| A.点a的正反应速率比点b的小 |
| B.点 c处反应达到平衡 |
| C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
D
解析试题分析:A.点a的正反应速率比点b的大,浓度大速率大,错误;B.达平衡时物质的量不变,点C处改变,未达到平衡,错误;C.点d (t1时刻) 和点 e (t2时刻) 处都达平衡,n(N2)不变,n(N2) 一样,错
误;D.673K--773K,温度升高,平衡向吸热反应,逆向进行,n(H2)比上图中d点的值大,正确;。
考点:考查化学平衡等相关知识。

练习册系列答案
相关题目
下列图示与对应的叙述相符的是( )。
A.图1表示可逆反应 温度 温度 的情形 的情形 |
B.图2表示压强对可逆反应 的影响,乙的压强比甲的压强大 的影响,乙的压强比甲的压强大 |
| C.图3中a、b、c三点中只有b点已经达到化学平衡状态 |
| D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线 |
某可逆反应平衡常数表达式为 。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是( )
A.反应的热化学方程式为NO2(g)+SO2(g)  NO(g)+SO3(g) ΔH>0 NO(g)+SO3(g) ΔH>0 |
| B.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深 |
| C.混合气体的平均摩尔质量保持不变,说明反应已达平衡 |
| D.使用合适的催化剂可使该反应的反应速率和平衡常数增大 |
在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
A.平衡常数K= |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.任意时刻,T2温度下的反应速率均大于T1温度下的速率 |
D.处于A点的反应体系从T1变到T2,达到平衡时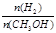 增大 增大 |
两体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g) 3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 |
| B.正反应是吸热反应 |
| C.t3时刻可能是增大了压强 |
| D.t3时刻可能是降低了温度 |
下列图示与对应的叙述相符的是
A.图I可表示N2+3H2 2NH3的速率时间图像,t1时刻改变的条件是升高温度 2NH3的速率时间图像,t1时刻改变的条件是升高温度 |
| B.图Ⅱ可表示用0.1 000 mol/L醋酸滴定40.00 mL0.1000 mol/LNaOH溶液得到的滴定曲线 |
| C.图Ⅲ可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2 |
| D.图Ⅳ可表示pH相同的NaOH溶液与氨水稀释过程的pH变化.其中曲线a对应氨水 |
将CO2转化为甲醇的原理为 CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
| A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 |
| B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) |
| C.平衡时H2的转化率为75% |
| D.500 ℃时该反应的平衡常数K=3 |
 xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是
xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是
 pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是