题目内容
【题目】在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)![]() CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
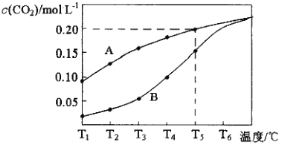
(1)该反应正反应为___(填“吸”或“放”)热反应,温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为___。
(2)如果该反应的平衡常数K值变大,该反应___ (选填编号)。
a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:___。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入0.5molN2,则最后平衡时容器中的CaCO3的质量为___ g。
(5)已知苯酚和碳酸的电离平衡常数如图所示。请写出二氧化碳通入苯酚钠溶液的化学反应离子方程式___,请用电离平衡原理解释上述反应发生的原因以及确定生成物的依据___。
物质 | 电离平衡常数(25℃) |
C6H5OH | Ki=1.28×10-10 |
H2CO3 | Ki1=4.3×10-7 |
Ki2=5.6×10-11 |
【答案】吸热 0.2 bc 随着温度升高,反应速率加快,达到平衡所需要的时间变短 10 C6H5O-+CO2+H2O→C6H5OH+HCO3- 二氧化碳与水结合生成碳酸,且碳酸酸性比苯酚酸性强,故能生成苯酚。碳酸的电离分两步:第一步:H2CO3![]() H++HCO3-,该步电离出的H+更容易结合C6H5O-生成酸性更弱的C6H5OH,导致第一步电离平衡正向移动,第二步电离:HCO3-
H++HCO3-,该步电离出的H+更容易结合C6H5O-生成酸性更弱的C6H5OH,导致第一步电离平衡正向移动,第二步电离:HCO3-![]() H++CO32-,C6H5OH酸性大于HCO3-,所以第二步电离出的H+更容易结合CO32-而不容易结合C6H5O-,故不影响第二步电离平衡
H++CO32-,C6H5OH酸性大于HCO3-,所以第二步电离出的H+更容易结合CO32-而不容易结合C6H5O-,故不影响第二步电离平衡
【解析】
(1)由图象判断温度与平衡移动的影响,再判断反应中的热效应;根据化学反应方程式可知,平衡常数K=c(CO2)计算;
(2)平衡常数增大,说明平衡正向移动,结合温度对平衡常数的影响判断;
(3)根据温度对反应速率的影响判断;
(4)由于容器体积不变,平衡体系中再充入0.5molN2,平衡不移动,据此计算;
(5)由电离平衡常数可知,苯酚的酸性弱于碳酸但比碳酸氢根强,据此答题。
(1)由图象可知,随着温度的升高,CO2平衡时的浓度增大,说明平衡向正反应方向移动,所以该反应为吸热反应。根据化学反应方程式可知,平衡常数K=c(CO2),所以T5℃时,K=c(CO2)=0.2;
(2)平衡常数增大,说明平衡正向移动,此时改变的条件为升高温度,如果该反应的平衡常数K值变大,则
a.一定向正反应方向移动,a错误;
b.在平衡移动时,由于是升高温度,所以正、逆反应速率都增大,由于该反应是吸热反应,所以平衡移动后温度会有所降低,所以正反应速率又逐渐减小,b正确;
c.一定向正反应方向移动,c正确;
d.根据b的分析可知,d错误;
故选bc;
(3)根据温度对反应速率的影响可知,随着温度升高,反应速率加快,达到平衡所需要的时间变短,所以曲线B向曲线A逼近;
(4)由于容器体积不变,平衡体系中再充入0.5molN2,平衡不移动,所以在T5℃时,n(CO2)=2L×0.2mol·L-1=0.4mol,则被分解的CaCO3的质量为100×0.4g=40g,所以平衡时容器中的CaCO3的质量为0.5mol×100g·mol-1-40g=10g;
(5)CO2入苯酚钠溶液的化学反应离子方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-,由电离平衡常数可知,苯酚的酸性弱于H2CO3但比HCO3-强,CO2与H2O结合生成H2CO3,且H2CO3酸性比苯酚酸性强,故能生成苯酚,H2CO3的电离分两步:第一步:H2CO3![]() H++HCO3-,该步电离出的H+更容易结合C6H5O-生成酸性更弱的C6H5OH,导致第一步电离平衡正向移动,第二步电离:HCO3-
H++HCO3-,该步电离出的H+更容易结合C6H5O-生成酸性更弱的C6H5OH,导致第一步电离平衡正向移动,第二步电离:HCO3-![]() H++CO32-,C6H5OH酸性大于HCO3-,所以第二步电离出的H+更容易结合CO32-而不容易结合C6H5O-,故不影响第二步电离平衡。
H++CO32-,C6H5OH酸性大于HCO3-,所以第二步电离出的H+更容易结合CO32-而不容易结合C6H5O-,故不影响第二步电离平衡。