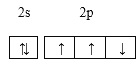
题目内容
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A.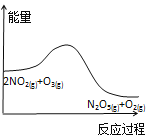 降低温度,平衡向正反应方向移动
降低温度,平衡向正反应方向移动
B. 0-3s内,反应速率v(NO2)=0.2mol·L-1
0-3s内,反应速率v(NO2)=0.2mol·L-1
C.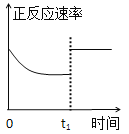 t1时仅加入催化剂,平衡正向移动
t1时仅加入催化剂,平衡正向移动
D.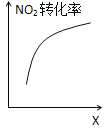 达到平衡时,仅改变X,则X为c(O2)
达到平衡时,仅改变X,则X为c(O2)
【答案】A
【解析】
A.由图可知,反应物总能量高于生成物总能量,正反应为放热反应,降低温度平衡向正反应方向移动,A正确;
B.由图可知,0~3s内,△c(NO2)=1mol·L-1-0.4mol·L-1=0.6mol·L-1,故v(NO2)= ![]() =0.2mol·L-1·s-1,单位错误,B错误;
=0.2mol·L-1·s-1,单位错误,B错误;
C.t1时刻,改变条件,反应速率加快,但正反应速率和逆反应速率仍相等,平衡不移动,该反应前后气体的物质的量减小,不是增大压强,只能是使用催化剂,但催化剂不影响平衡的移动,C错误;
D.达到平衡时,仅增大c(O2),平衡向逆反应方向移动,NO2转化率降低,由图可知,NO2的转化率随x增大而增大,x可以代表O3浓度、压强,D错误。
答案选A。

【题目】在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)![]() CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
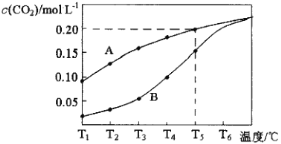
(1)该反应正反应为___(填“吸”或“放”)热反应,温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为___。
(2)如果该反应的平衡常数K值变大,该反应___ (选填编号)。
a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:___。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入0.5molN2,则最后平衡时容器中的CaCO3的质量为___ g。
(5)已知苯酚和碳酸的电离平衡常数如图所示。请写出二氧化碳通入苯酚钠溶液的化学反应离子方程式___,请用电离平衡原理解释上述反应发生的原因以及确定生成物的依据___。
物质 | 电离平衡常数(25℃) |
C6H5OH | Ki=1.28×10-10 |
H2CO3 | Ki1=4.3×10-7 |
Ki2=5.6×10-11 |