题目内容
【题目】已知可逆反应:![]() ,请回答下列问题:
,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:![]() ,
,![]() ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为![]() ,求此时N的转化率____。
,求此时N的转化率____。
(2)若反应温度不变,反应物的起始浓度分别为:![]() ,
,![]() ,达到平衡后,
,达到平衡后,![]() ,求a的值____。
,求a的值____。
【答案】25% 6
【解析】
先根据已知条件列出三段式,结合公式及定义求解。
(1)转化率=![]() ×100%;
×100%;
(2)由于温度不变,则平衡常数不变,与(1)相同,以此计算。
依据化学平衡三段式列式计算,达到平衡后,M的转化率为60%,反应浓度=1molL-1×60%=0.6mol/L,则有:
M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始浓度(mol/L) 1 2.4 0 0
转化浓度(mol/L) 0.6 0.6 0.6 0.6
平衡浓度(mol/L) 0.4 1.8 0.6 0.6
(1)N的转化率=![]() ×100%=
×100%=![]() ×100%=25%,平衡常数K=
×100%=25%,平衡常数K=![]() 。故答案为:25%;
。故答案为:25%;
(2) M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始浓度(mol/L) 4 a 0 0
转化浓度(mol/L) 2 2 2 2
平衡浓度(mol/L) 2 a-2 2 2
由于温度不变,则平衡常数不变,与(1)相同,K=0.5,则有:![]() =0.5,解之得a=6,故答案为:6。
=0.5,解之得a=6,故答案为:6。

【题目】近年科学家提出“绿色自由”构想。把空气中的CO2进行转化,并使之与H2反应生成可再生能源甲醇。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①下列关于氢能的说法正确的是____。
A.氢能是清洁能源 B.氢能是二次能源
C.氢能是不可再生能源 D.气态氢能源更容易保存和运输
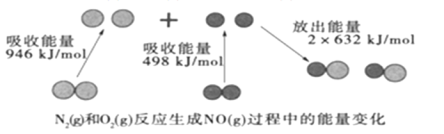
②已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJmol-1、-285.8kJmol-1。CO与H2合成甲醇的能量变化如图甲所示:
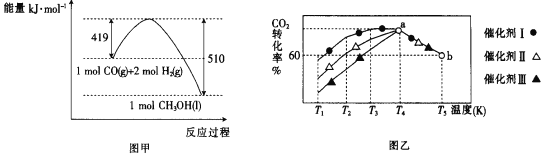
则用CO2(g)和H2(g)制备液态甲醇的热化学方程式为____。
③将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:催化效果最好的是催化剂____(选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应,得到三组数据如表所示:
温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
650 | 4 | 2 | 1.6 | 10 | |
900 | 3 | 2 |
| 5 | |
900℃时,达到平衡时的反应速率v(H2O)=____。(保留2位小数)。
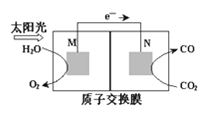
(3)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为____。