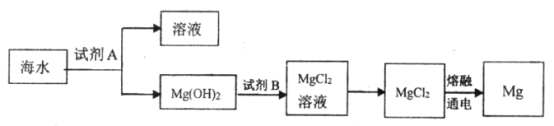
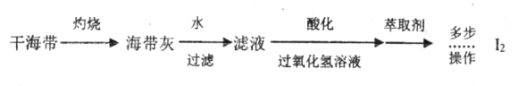
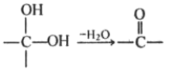题目内容
【题目】为了测定乙醇的结构式,利用乙醇和钠的反应,设计如图1装置进行实验,在烧瓶中放入足量的钠,从分液漏斗中缓缓滴入一定量的乙醇,通过测量量筒中水的体积,就可知反应生成的氢气的体积。
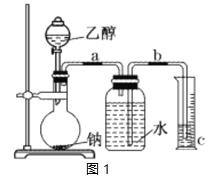
(1)实验前检验该装置的气密性的实验操作是__。
(2)有人认为装置中有空气,所测的气体体积应扣除装置中空气的体积,才是氢气的体积,你认为__(填“正确”或“不正确”)。
(3)若实验中所用乙醇含有少量水则实验结果将_(填“偏大”或“偏小”),若实验开始前b导管内未充满水则实验结果将__(填“偏大”或“偏小”)。
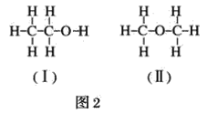
(4)若测得有1.15gC2H6O参加反应,把量筒c中的水的体积换算成标准状况下H2的体积为280mL,试结合计算和讨论,判断图2中(Ⅰ)和(Ⅱ)两式中,哪个正确__。
【答案】连接好装置,关闭分液漏斗的活塞,将右侧导管插入水槽,微热烧瓶,右侧导管若有气泡冒出,冷却后形成一段水柱,且一段时间内水柱不变化,证明装置气密性良好 不正确 偏大 偏小 Ⅰ
【解析】
(1)利用压强差检查装置气密性;
(2)原来装置中有空气,反应后装置中有氢气,故排出的气体的体积即为氢气的体积;
(3)等质量的水与钠反应产生氢气比乙醇与钠反应产生氢气多;如果实验开始前b导管内未充满水时,排到量筒中的水的体积偏小;
(4)测定乙醇结构的实验原理是用一定量的乙醇与钠反应,测定产生氢气的体积,由此计算出1 mol 乙醇分子中被置换氢原子的物质的量,然后根据两者的物质的量之间的关系来分析结构。
(1)检查气密性,首先形成液封,即先关闭分液漏斗活塞,把导管插入液面下,然后手捂烧瓶,使装置内外压强不同,则看到有气泡冒出,松开手会看到导管液面上升,则证明气密性良好;故答案为:连接好装置,关闭分液漏斗的活塞,将右侧导管插入水槽,微热烧瓶,右侧导管若有气泡冒出,冷却后形成一段水柱,且一段时间内水柱不变化,证明装置气密性良好;
(2)原来装置中有空气,但反应后装置中仍有氢气,排出的气体的体积即为氢气的体积,所以“所测的气体体积应扣除装置中空气的体积,才是氢气的体积”不正确;故答案为:不正确;
(3)等质量的水与钠反应产生氢气比乙醇与钠反应产生氢气多,如果乙醇含有水,则导致实验结果偏大;如果实验开始前b导管内未充满水时,排到量筒中的水的体积偏小,则导致实验结果偏小;故答案为:偏大;偏小;
(4)1.15 g C2H6O的物质的量![]() ,生成氢气的物质的量
,生成氢气的物质的量![]() ,即1 mol C2H6O~0.5 mol H2~1mol H,说明1 mol C2H6O分子中只有1mol 氢原子被钠置换,也就是说C2H6O分子中有1个氢原子与其他5个氢原子不同,其结构应为Ⅰ;故答案为:Ⅰ。
,即1 mol C2H6O~0.5 mol H2~1mol H,说明1 mol C2H6O分子中只有1mol 氢原子被钠置换,也就是说C2H6O分子中有1个氢原子与其他5个氢原子不同,其结构应为Ⅰ;故答案为:Ⅰ。

 阅读快车系列答案
阅读快车系列答案