题目内容
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A.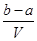 mol·L-1 mol·L-1 | B.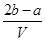 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 | D.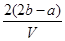 mol·L-1 mol·L-1 |
D
解析试题分析:两等份溶液中一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式知
2n(Mg2+)=n(OH-),另一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知
n(SO42-)=n(Ba2+),由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),故每份中溶液n(K+)=(2b-a)mol,故原溶液中钾离子浓度=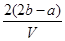 mol·L-1,选D。
mol·L-1,选D。
考点:考查电解质溶液计算——电荷守恒法。

练习册系列答案
相关题目
当0.2molNa218O2足量CO2完全反应后所得固体的质量为( )
| A.21.2g | B.21.6g | C.22.0g | D.22.4g |
下列各项表达中正确的是
A.乙烯的电子式: |
B.羟基的电子式为: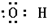 |
C.甘油的结构简式: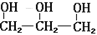 |
| D.苯酚分子式:C6H5OH |
下列有关化学用语表示正确的是( )
A.乙炔的电子式: |
B. 和 和 是同一物质 是同一物质 |
C.对甲基苯甲醇的结构简式: |
D.乙醇分子的比例模型: |
实验室需要2.0 mol·L-1NaOH溶液90mL,请回答下列问题:
(1)配制过程中不需要使用到的化学仪器有 (填字母)
| A.烧杯 | B.100mL容量瓶 | C.漏斗 | D.胶头滴管 E.玻璃棒 |
(3)下列主要操作步骤的正确顺序是 (填序号);
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1—2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中;
(4)在实验中其他操作均正确,如实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度 (填“偏高”或“偏低”或“不变”);若定容时仰视刻度线,则所得溶液浓度 2.0 mol·L-1(填“大于”或“小于”或“等于”)。
若20 g密度为ρ g·cm-3的硝酸钙溶液里含1 g Ca2+,则NO3-的物质的量浓度是
| A.2.5ρ mol·L-1 | B. mol·L-1 mol·L-1 | C. mol·L-1 mol·L-1 | D.1.25ρ mol·L-1 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,11.2L的水中含有0.5个NA水分子 |
| B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Mg2+的个数为0.5NA |
| C.1 mol H2和O2的混合气体中含NA个分子 |
| D.11.2L NH3中所含的原子数目为2NA |
下列说法正确的是(NA表示阿伏加德罗常数的值) ( )
| A.1.8g NH4+所含质子数为NA |
| B.通常状况下,NA个CO2分子占有的体积为22.4 L |
| C.物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl-个数为NA |
| D.1 mol·L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol·L-1 |
下列溶液中的氯离子浓度与50 mL 1 mol/L的AlCl3溶液中氯离子浓度相等的是( )。
| A.150 mL 1 mol/L的NaCl | B.75 mL 3 mol/L的NH4Cl |
| C.150 mL 2 mol/L的KCl | D.75 mL 2 mol/L的CaCl2 |