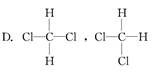
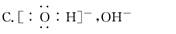题目内容
下列说法正确的是(NA表示阿伏加德罗常数的值) ( )
| A.1.8g NH4+所含质子数为NA |
| B.通常状况下,NA个CO2分子占有的体积为22.4 L |
| C.物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl-个数为NA |
| D.1 mol·L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol·L-1 |
D
解析试题分析:A选项NH4+中的质子数位11,所以换算错误。B选项应在标准状况下,错误。C选项没有溶液的体积,无法换算,错误。D选项正确。
考点:物质的量基本公式换算。

练习册系列答案
相关题目
下列两种气体的分子数一定相等的是 ( )
| A.质量相等、密度不等的N2和C2H4 |
| B.等体积等密度的NO和N2 |
| C.等体积的O2和N2 |
| D.质量相等的N2和CO2 |
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A.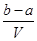 mol·L-1 mol·L-1 | B.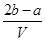 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 | D.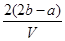 mol·L-1 mol·L-1 |
448 mL 某气体在标准状况下的质量为1.28 g,该气体的摩尔质量约为
| A.46 g | B.44 | C.64 g/mol | D.32 g/mol |
将0.1mol·L-1K2SO4溶液、0.2mol·L-1Fe2(SO4)3溶液与水混合,欲使混合溶液中K+、Fe3+、SO42-物质的量浓度为0.1mol·L-1、0.1mol·L-1、0.2mol·L-1,则所用的K2SO4溶液,Fe2(SO4)3溶液、水的体积比约为( )
| A.1:1:1 | B.2:1:1 | C.1:1:2 | D.2:1:2 |
150℃时,NH4HCO3分解为NH3、H2O、CO2三种物质,此时混合气的密度是相同条件下的氢气密度的大约
| A.26.3倍 | B.12倍 | C.15.25倍 | D.13.2倍 |
NA表示阿伏加德罗常数,下列说法中正确的是
| A.2.4g镁与足量的盐酸反应,电子转移数目为0.1NA |
| B.0.5mol/L的Na2SO4的溶液中含NA个Na+ |
| C.1molNa2O2固体中含2NA个阴离子 |
| D.1molCH5+离子所含电子数为10NA |
下列各组中的两种气体的分子数一定相同的是
| A.质量相等但密度不等的N2和C2H4 | B.体积相同的N2和C2H4 |
| C.等温、等体积的N2和O2 | D.等压、等体积N2和CO2 |