题目内容
【题目】自来水生产过程中,可用氯气等物质作消毒剂,明矾等物质作絮凝剂。出厂的自来水中含少量可溶性矿物质。完成下列填空:
(1)自来水中含硫量约70 mg/L,它只能以______(填微粒符号)形态存在,不能以其它形态存在的原因是________________________。
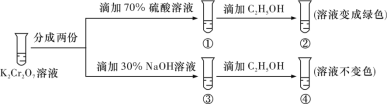
(2)已知在碱性条件下,氯气会发生自身氧化还原反应,某反应体系中的物质为:KClO3、Cl2、KCl、KOH、H2O。
①写出该反应的化学方程式。____________________________。
②该反应中氧化剂与还原剂的质量比为_________。
(3)实验室利用反应6HCl+KClO3 → KCl+3H2O+3Cl2↑制取Cl2,当产生标准状况下的气体3.36 L时,转移电子_____mol。
(4)不同环境中,物质的性质可能会有所不同。根据上述两题的反应中KClO3和Cl2的氧化性强弱比较,你能得出的结论是________________________。
(5)铝铵矾[NH4Al(SO4)212H2O]也是常用的工业净水剂,其净水的化学原理是________________(用离子方程式表示)。
(6)在向铝铵矾溶液中逐滴滴加氢氧化钡溶液的过程中,下列关系可能正确的是_________。(选填编号)
a.n(SO42-)>n(NH4+)>n(A13+)>n(OH-)
b.n(A13+)>n(NH4+)>n(SO42-)>n(H+)
c.n(BaSO4)>n[A1(OH)3]>n(NH3·H2O)>n(A1O2-)
d.n(NH3·H2O)>n(BaSO4)>n[A1(OH)3]>n(A1O2-)
【答案】SO42- 自来水中有Cl2,具有强氧化性。(或者SO42-是硫最稳定的化合态) 3Cl2+6KOH=5KCl+KClO3+3H2O 5:1 0.25 酸碱性不同,氯气和氯酸钾的氧化性强弱不同(或碱性条件下,氯气氧化性强;酸性条件下,氯酸钾氧化性强) Al3++3H2O![]() Al(OH)3+3H+ ac
Al(OH)3+3H+ ac
【解析】
(1)自来水中含有氯气,氯气具有强氧化性,能把含S化合物转化为硫酸根离子;
(2)①氯气与KOH反应生成KClO3、KCl和H2O,根据电子守恒、原子守恒,可得反应方程式;
②氧化剂得电子,还原剂失电子,根据得失电子守恒分析;
(3)根据方程式中转移电子数目与反应产生氯气的物质的量关系进行计算;KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,生成3 mol Cl2转移5 mol电子;
(4)物质的氧化性强弱与溶液的酸碱性有关;
(5)铝离子水解生成氢氧化铝胶体能净水;
(6)a.向硫酸铝铵矾溶液NH4Al(SO4)2中滴加极少量的氢氧化钡溶液,溶液相当于铝铵矾溶液;
b.滴加氢氧化钡溶液首先与铝离子反应,所以整个过程中n(Al3+)<n(NH4+);
c.当硫酸根离子完全沉淀,则铵根离子部分反应,则铝离子全部变成氢氧化铝,而偏铝酸根离子的物质的量为0,由此分析解答;
d.溶液中硫酸钡的物质的量最大,所以不可能出现n(NH3H2O)>n(BaSO4)。
(1)自来水中含有氯气,氯气具有强氧化性,能把含S化合物转化为硫酸根离子,所以自来水中的硫以SO42-的形态存在;
(2)①氯气与KOH反应生成KClO3、KCl和H2O,其反应的化学方程式为:3Cl2+6KOH=5KCl+KClO3+3H2O;
②在该反应中,Cl2作氧化剂得电子,Cl2作还原剂失电子,在方程式3Cl2+6KOH=5KCl+KClO3+3H2O中,3 mol Cl2中含有6 mol Cl原子,其中得电子的Cl为5,失电子的Cl为1,则氧化剂与还原剂的物质的量之比为5:1;
(3)在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,生成3 mol Cl2转移5 mol电子,制取标准状况下3.36 L氯气的物质的量n(Cl2)=![]() =
=![]() =0.15 mol,则转移电子的物质的量为n(e-)=0.15 mol×
=0.15 mol,则转移电子的物质的量为n(e-)=0.15 mol×![]() =0.25 mol;
=0.25 mol;
(4)酸性条件下发生氧化还原反应,KClO3作氧化剂,碱性条件下,氯气是氧化剂,则溶液的酸碱性不同,氯气和氯酸钾的氧化性强弱不同;
(5)铝铵矾[NH4Al(SO4)212H2O]是常用的工业净水剂,在水中电离出Al3+,Al3+水解生成Al(OH)3胶体表面积大,吸附力强,能够吸附水中悬浮的固体颗粒使之形成沉淀,从而具有净水作用,其水解的离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(6)a.向硫酸铝铵矾溶液NH4Al(SO4)2中滴加极少量的氢氧化钡溶液,相当于铝铵矾溶液,所以离子浓度为:n(SO42-)>n(NH4+)>n(Al3+)>n(H+)>n(OH-),a正确;
b.滴加氢氧化钡溶液首先与Al3+反应,所以整个过程中n(Al3+)<n(NH4+),b错误;
c.当SO42-完全沉淀,NH4+部分反应,则Al3+全部变成Al(OH)3,而AlO2-的物质的量为0,所以离子物质的量大小关系为:n(BaSO4)>n[A1(OH)3]>n(NH3·H2O)>n(A1O2-),c正确;
d.NH4Al(SO4)2中,SO42-的物质的量是NH4+的2倍,则溶液中BaSO4的物质的量最大,所以不可能出现n(NH3·H2O)> n(BaSO4),d错误;
故合理选项是ac。/p>

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下达平衡后,增大压强平衡不移动
B.该反应方程式可表示为:X+2Y=3W
C.升高温度,若W的体积分数减小,则此反应ΔH>0
D.恒温恒容时,增加X的物质的量,平衡向正向移动,X的转化率提高