题目内容
【题目】NA为阿伏加德罗常数,关于a g亚硫酸钠晶体(Na2SO37H2O)的说法中正确的是
A.含Na+数目为![]() NAB.含氧原子数目为
NAB.含氧原子数目为![]() NA
NA
C.完全氧化SO32-时转移电子数目为![]() NAD.含结晶水分子数目为
NAD.含结晶水分子数目为![]() NA
NA
【答案】D
【解析】
A. a g亚硫酸钠晶体(Na2SO37H2O)的物质的量n=![]() mol,而1 mol Na2SO37H2O中含2molNa+,故
mol,而1 mol Na2SO37H2O中含2molNa+,故![]() mol Na2SO37H2O中含
mol Na2SO37H2O中含![]() mol,即
mol,即![]() mol钠离子,A错误;
mol钠离子,A错误;
B. a g亚硫酸钠晶体(Na2SO37H2O)的物质的量n=![]() mol,而1 mol Na2SO37H2O中含10 mol氧原子,故
mol,而1 mol Na2SO37H2O中含10 mol氧原子,故![]() mol Na2SO37H2O中含氧原子
mol Na2SO37H2O中含氧原子![]() mol,即含有
mol,即含有![]() mol的O原子,B错误;
mol的O原子,B错误;
C. SO32-被氧化时,由+4价被氧化为+6价,即1 mol SO32-转移2 mol电子,故![]() mol Na2SO37H2O转移
mol Na2SO37H2O转移![]() mol 电子,C错误;
mol 电子,C错误;
D. 1 mol Na2SO37H2O中含7 mol水分子,故![]() mol Na2SO37H2O中含水分子数目为
mol Na2SO37H2O中含水分子数目为![]() mol×7×NA/mol=
mol×7×NA/mol=![]() NA,D正确;
NA,D正确;
故合理选项是D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
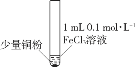
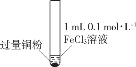
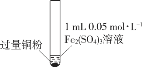
小学生10分钟应用题系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验 步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验 现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀