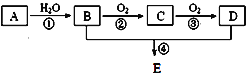
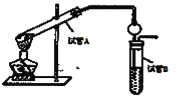
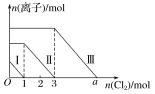
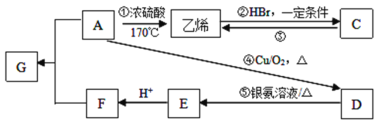
题目内容
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸、浓硫酸反应生成SeO2以回收Se。在回收过程中涉及如下化学反应:①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;③Se+4HNO3(浓)=SeO2+4NO2↑+2H2O;
下列有关叙述正确的是( )
A.氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B.反应①中Se是氧化产物,I2是还原产物
C.反应①中生成0.6molI2,转移的电子数目为2.4NA
D.反应②③中等量的Se消耗浓硫酸和浓硝酸中溶质的物质的量之比为2:1
【答案】A
【解析】
A.在同一反应中氧化剂氧化性大于氧化产物氧化性,则根据![]() 可知氧化性:
可知氧化性:![]() ,
,![]() 中氧化性:
中氧化性:![]() 浓
浓![]() ,则氧化性由强到弱的顺序是
,则氧化性由强到弱的顺序是![]() 浓
浓![]() ,故A正确;
,故A正确;
B.反应![]() 中,Se元素的化合价降低,被还原,I元素的化合价升高,被氧化,则Se是还原产物,
中,Se元素的化合价降低,被还原,I元素的化合价升高,被氧化,则Se是还原产物,![]() 是氧化产物,故B错误;
是氧化产物,故B错误;
C.根据化合价的变化可知,反应![]() 中每有
中每有![]() 生成,转移的电子数目应为
生成,转移的电子数目应为![]() ,故C错误;
,故C错误;
D.由反应可知,设Se均为1mol,由反应![]() 、
、![]() 可知等量的Se消耗浓
可知等量的Se消耗浓![]() 和浓
和浓![]() 的物质的量之比为2:
的物质的量之比为2:![]() :2,故D错误。
:2,故D错误。
答案选A。

【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D