题目内容
20.开发新能源、新材料是实现社会可持续发展的需要.请回答下列问题:(1)图1为LiBH4/MgH2体系放氢焓变示意图.

则:Mg(s)+2B(s)=MgB2(s)△H=-93 kJ•mol-1.
(2)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:25℃水浴时,每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系如图2示.下列说法正确的是AB(填字母).
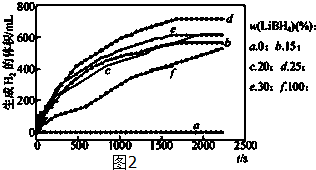
A.25℃时,纯铝与水不反应
B.25℃时,纯LiBH4与水反应产生氢气
C.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
(3)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为
CO(g)+2H2(g)?CH3OH(g).

①在一容积可变的密闭容器中,充有10molCO和20mol H2,用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图3所示.则:上述合成甲醇的反应为放热反应(填“放热”或“吸热”).
平衡常数KA、KB、KC的大小关系为KA=KB>KC.
若达到平衡状态A时容器的体积为10L,则平衡状态B时容器的体积为2L.
②图中虚线为该反应在使用催化剂条件下,起始H2、CO投料比和CO平衡转化率的关系图.当其他条件完全相同时,用实线画出不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图.
(4)次磷酸钴[Co(H2PO2)2]广泛应用于化学镀钴,工业上利用电解法制备次磷酸钴的电极材料为金属钴和不锈钢,其电解装置如图4所示(其中阴离子交换膜只允许阴离子通过,其中阳离子交换膜只允许阳离子通过).则:
①N极的电极反应式为:2H2O+2e-=H2↑+OH- 或2H++2e-=H2↑;
②次磷酸钴在I区生成(填“Ⅰ、Ⅱ或Ⅲ”).
③已知次磷酸与足量氢氧化钠溶液反应的化学方程式为:
H3PO2+NaOH=NaH2PO2+H2O,则NaH2PO2溶液中离子浓度由大到小的顺序为c(Na+)>c(H2PO2-)>c(OH-)>c(H+).
分析 (1)由图可知:①.2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1,
②2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1
③2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1
④2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1,即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1,
所以-④-②得:Mg(s)+2B(s)═MgB2(s),据盖斯定律计算反应的焓变;
(2)①A.由图知LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,;
B.纯Al不与水反应,而Al-LiBH4复合材料能与水反应生成氢气,应是LiBH4与水反应生成氢气;
C.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量为25%时,1000s内产生氢气的体积最大;
(3)①由图可知,随温度升高CO的转化率减小,说明升高温度平衡向逆反应方向移动;
温度不变,化学平衡常数不变,温度升高平衡向吸热的方向移动,平衡常数减小;
根据CO的转化率计算平衡时A中各组分物质的量,再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,A、B两点温度相同,二者平衡常数相同,结合B中CO转化率计算平衡时B中各组分物质的量,再根据平衡常数计算平衡时B容器的容积;
②不使用催化剂情况下,反应速率减慢,到达平衡时间变长,不影响平衡移动,平衡时CO转化率不变;
(4)①②由图可知,H2PO2-经过阴离子交换膜进入I室生成Co(H2PO2)2,则M为阳极,N为阴极,阴极上为水放电生成氢气与氢氧根离子,Na+经过阳离子交换膜进入Ⅱ室,有NaOH生成;
③氢氧化钠足量,发生反应:H3PO2+NaOH=NaH2PO2+H2O,则H3PO2为一元酸,溶液中H2PO2-水解呈碱性.
解答 解:(1)由图可知:①.2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1,
②2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1
③2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1
④2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1,即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1,
所以-④-②得:Mg(s)+2B(s)═MgB2(s),则△H=-(17+76)kJ•mol-1,
故答案为:-93 kJ•mol-1;
(2)①A.由图知LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,故A正确;
B.纯Al不与水反应,而Al-LiBH4复合材料能与水反应生成氢气,应是LiBH4与水反应生成氢气,故B正确;
C.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量为25%时,1000s内产生氢气的体积最大,故C错误,
故选:AB;
(3)①由图可知,随温度升高CO的转化率减小,说明升高温度平衡向逆反应方向移动,正反应为放热反应;
因B点与A点温度相同,K不变,对于上述反应温度升高平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC;
T1时,A点对应的α=0.5,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):10 20 0
变化量(mol):5 10 5
平衡量(mol):5 10 5
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{5}{10}}{\frac{5}{10}×(\frac{10}{10})^{2}}$=1,A、B两点温度相同,二者平衡常数相同,
B中平衡时CO转化率为0.8,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):10 20 0
变化量(mol):8 16 8
平衡量(mol):2 4 8
设平衡时B容器的容积为VL,则:$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得V=2,
故答案为:放热;KA=KB>KC;2;
②不使用催化剂情况下,反应速率减慢,到达平衡时间变长,不影响平衡移动,平衡时CO转化率不变,不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图: ,
,
故答案为: ;
;
(4)由图可知,H2PO2-经过阴离子交换膜进入I室生成Co(H2PO2)2,则M为阳极,N为阴极,阴极上为水放电生成氢气与氢氧根离子,Na+经过阳离子交换膜进入Ⅱ室,有NaOH生成.
①N极的电极反应式为:2H2O+2e-=H2↑+OH- 或2H++2e-=H2↑,故答案为:2H2O+2e-=H2↑+OH- 或2H++2e-=H2↑;
②次磷酸钴在I区生成,故答案为:I;
③氢氧化钠足量,发生反应:H3PO2+NaOH=NaH2PO2+H2O,则H3PO2为一元酸,溶液中H2PO2-水解呈碱性,溶液中离子浓度为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+).
点评 本题考查化学平衡计算、反应热有关计算、电解原理应用、离子浓度大小比较等,是对学生总能力的考查,难度较大.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 澄清的石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

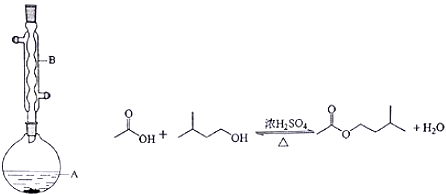
(1)生成1-溴丁烷的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(2)由于副反应的发生而可能产生的副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3.(至少两种,有机物用结构简式表示)
(3)为了将反应混合物中1-溴丁烷及时分离出,应选用的装置是D(填序号),该操作应控制的温度t2范围是101.6℃≤t<117.25℃.
(4)在得到的1-溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”).
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1-溴丁烷的质量为22.2g,本实验的产率约是C(填正确答案标号).
A.40% B.50% C.60% D.70%
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

| A. | 温度升髙,该反应的平衡常数减小 | |
| B. | 0〜10min,HCOOCH3的平均反应速率v=0.003mol•L-1min-1 | |
| C. | HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变 | |
| D. | 该条件下达到平衡状态,反应物转化率相等 |
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙 酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的作用是冷凝回流
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸;第二次水洗的主要目的是:洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高异戊醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯
(6)在蒸馏操作中,仪器选择及安装都正确的是:b(填标号)

(7)本实验的产率是60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |

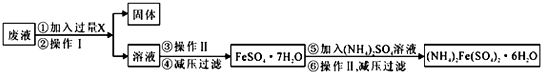
 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题: