题目内容
3.发展“碳-化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.下面是以焦炭为原料,经“碳-化学”途径制取乙二醇的过程:
(1)乙二醇(I)和谁的汽化热都为44Kj.mol-1,其燃烧热△H=-1824kJ.mol-1.试写出乙二醇(g)完全燃烧生成气态水的热化学方程式CH2(OH)CH2(OH)(g)+$\frac{5}{2}$O2(g)=2CO2(g)+3H2O(g)△H=-1736KJ/mol.
(2)“催化还原”反应制乙二醇原理如下:
CH3OOC.COOCH3(g)+4H2(g)?HOCH2.CH2OH(g)+2CH3OH(g)△H=-34kJ/mol-1.
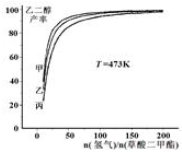
为探究实际生产的最佳条件,某科研小组进行了多方面研究.如图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则图1曲线甲对应的压强为P(甲)=3.5MPa.
(3)草酸二甲酯水解产物草酸(H2C2O4)为二元弱酸,受热分解,其钡盐难溶于水,它在水溶液中存在形式的分布于pH关系如图所示:

①草酸的Ka1=6.3×10-2,Ka2=6.3×10-5.已知H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7.试写出在K2C2O4溶液中通入少量SO2发生的离子方程式SO2+H2O+C2O42-=HC2O4-+HSO3-.
②试写出pH=3的溶液加中氨水升至6的过程中反应的离子方程式:HC2O4-+NH3.H2O=NH4++C2O42-+H2O.
③向0.1mol.L-1的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系不正确的是B(填序号)

A.c(K+)-c(C2O42-)=c(HC2O4-)+c(H2C2O4)
B.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
C.c(H2C2O4)+c(Na+)=c(C2O42-)
D.c(K+)>c(Na+)
④在恒温下,在草酸溶液中滴加酸性高锰酸钾溶液发生如下反应:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++H2O,反应速率随时间的变化如图3所示,试解释t1-t2反应速率随时间变化的可能原因反应生成的Mn2+可作该反应的催化剂,加快了反应的进行
⑤试设计实验证明K2C2O4溶液中存在水解平衡取少量K2C2O4溶液滴加酚酞溶液,溶液呈红色,加热,若溶液颜色加深,说明K2C2O4溶液中存在水解平衡.
分析 (1)乙二醇(I)和水的汽化热都为44KJ.mol-1,其燃烧热△H=-1824kJ.mol-1.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合盖斯定律计算得到乙二醇(g)完全燃烧生成气态水的热化学方程式;
(2)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,据此判断;
(3)①草酸为二元弱酸,分步电离,H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,图象分析可知,当c(H2C2O4)?c(HC2O4-),Ka1=c(H+)1,当c(HC2O4-)?C(C2O42-)Ka2=c(H+)2;在K2C2O4溶液中通入少量SO2发生反应,依据电离平衡常数分析可知,反应生成草酸氢根离子和亚硫酸氢根离子;
②草酸氢钾溶液加中氨水升至6的过程中反应生成草酸铵、草酸钾和水;
③a.根据物料守恒判断;
b.根据电荷守恒判断;
c.根据物料守恒、电荷守恒判断;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些;
④在草酸溶液中滴加酸性高锰酸钾溶液发生反应,速率显增大,后减小是反应生成的锰离子对反应起到了催化作用,随反应进行浓度减小,反应速率减小;
⑤K2C2O4溶液中C2O42-离子水解溶液呈碱性,滴入酚酞变红色,可以加热的方法观察溶液红色变化判断溶液中存在水解平衡;
解答 解:(1)①CH2(OH)CH2(OH)(l)=CH2(OH)CH2(OH)(g)△H=+44KJ/mol,
②H2O(l)=H2O(g)△H=+44KJ/mol,
③CH2(OH)CH2(OH)(l)+$\frac{5}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-1824KJ/mol;
结合盖斯定律③-①+3×②得到CH2(OH)CH2(OH)(g)+$\frac{5}{2}$O2(g)=2CO2(g)+3H2O(g)△H=-1736KJ/mol,
故答案为:CH2(OH)CH2(OH)(g)+$\frac{5}{2}$O2(g)=2CO2(g)+3H2O(g)△H=-1736KJ/mol;
(2)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,故曲线甲对应的压强是P(甲)=3.5MPa,
故答案为:3.5MPa;
(3)①草酸为二元弱酸,分步电离,H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,图象分析可知,当c(H2C2O4)?c(HC2O4-),Ka1=c(H+)1,当c(HC2O4-)?C(C2O42-)Ka2=c(H+)2,Ka1=6.3×10-2,则Ka2=c(H+)2=6.3×10-5,已知H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7.在K2C2O4溶液中通入少量SO2发生反应生成草酸氢钾、亚硫酸氢钾,反应的离子方程式为:SO2+H2O+C2O42-=HC2O4-+HSO3-,
故答案为:6.3×10-5,SO2+H2O+C2O42-=HC2O4-+HSO3-;
②草酸氢钾溶液加中氨水升至6的过程中反应生成草酸铵、草酸钾和水,反应的离子方程式为:HC2O4-+NH3.H2O=NH4++C2O42-+H2O,
故答案为:HC2O4-+NH3.H2O=NH4++C2O42-+H2O;
③A.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故A正确;
B.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故B错误;
C.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,c(Na+)=c(C2O42-)-c(H2C2O4),故C正确;
D.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故D正确;
故答案为:B;
④在草酸溶液中滴加酸性高锰酸钾溶液发生反应,速率显增大,后减小,t1-t2反应速率随时间变化的可能原因是反应生成的锰离子对反应起到了催化作用,随反应进行浓度减小,反应速率减小;
故答案为:反应生成的Mn2+可作该反应的催化剂,加快了反应的进行;
⑤K2C2O4溶液中C2O42-离子水解溶液呈碱性,滴入酚酞变红色,实验设计为:取少量K2C2O4溶液滴加酚酞溶液,溶液呈红色,加热,若溶液颜色加深,说明K2C2O4溶液中存在水解平衡
故答案为:取少量K2C2O4溶液滴加酚酞溶液,溶液呈红色,加热,若溶液颜色加深,说明K2C2O4溶液中存在水解平衡.
点评 本题考查了热化学方程式书写,物质制备方法和实验过程分析判断,图象分析、电解质溶液中离子浓度大小比较,电荷守恒的分析应用,掌握基础是解题关键,题目难度中等.

| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

(1)生成1-溴丁烷的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(2)由于副反应的发生而可能产生的副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3.(至少两种,有机物用结构简式表示)
(3)为了将反应混合物中1-溴丁烷及时分离出,应选用的装置是D(填序号),该操作应控制的温度t2范围是101.6℃≤t<117.25℃.
(4)在得到的1-溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”).
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1-溴丁烷的质量为22.2g,本实验的产率约是C(填正确答案标号).
A.40% B.50% C.60% D.70%
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 单质 | 氧化物 | 混合物 | 胶体 | 电解质 | 非电解质 |
| 属于该类的物质 | ② | ④ | ⑧⑨ | ⑦ | ③⑤⑥ | ①④ |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-,17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为0.6mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为CO2+2OH-=CO32-+H2O.
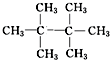
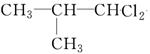 、
、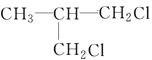 、
、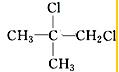 .
.

 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题: