题目内容
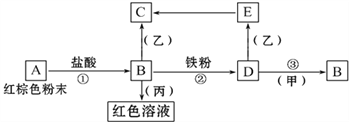
【题目】Ⅰ.如图1所示,已知有机物A,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种聚合物,生活中用于制造食物保鲜膜。

(1)写出B中官能团的电子式___;
(2)写出下列物质转化的化学方程式:
B→C:___;
B+D→E:___;
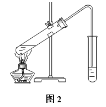
Ⅱ.(3)在实验室可以用如图2所示的装置进行B与D的反应,装置中通蒸气的导管要插在___溶液的液面上方,若要把制得的乙酸乙酯分离出来,应采用的实验操作是___。
Ⅲ.苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图3所示:
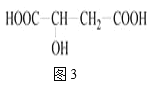
(4)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(5)在一定条件下,苹果酸可能与下列哪些物质发生反应___?
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
【答案】![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2
2![]() +2H2O
+2H2O ![]() +HOC2H5
+HOC2H5![]()
![]() +H2O 饱和Na2CO3溶液 分液 33.6 ABCD
+H2O 饱和Na2CO3溶液 分液 33.6 ABCD
【解析】
Ⅰ有机物A的产量是衡量一个国家石油化工水平的标志,A是乙烯,则A和水发生加成得到乙醇,B为乙醇,乙醇发生催化氧化得到乙醛,乙醛再氧化得到乙酸,乙醇和乙酸发生酯化反应得到乙酸乙酯;F是一种聚合物,为A乙烯发生加聚反应得到,为聚乙烯。
Ⅰ(1)根据分析B为乙醇,其官能团为-OH,其电子式为![]() ;
;
(2)B生成C为乙醇的催化氧化,化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
B和D为乙醇和乙酸反应生成乙酸乙酯,醇脱去羟基中的H,酸脱去羧基中的羟基,化学方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
Ⅱ(3)由于乙酸、乙醇均易发挥,因此乙酸乙酯中会含有乙酸、乙醇,可用饱和Na2CO3溶液,溶解乙醇,中和挥发出来的乙酸,也可以降低乙酸乙酯在水中的溶解度,为了防倒吸,导管不能插入液面以下;由于乙酸乙酯不溶于Na2CO3溶液,因此会分层,在上层,可以通过分液得到;
Ⅲ(4)苹果醋中的-OH、-COOH均可以与Na反应,因此1mol苹果醋与金属钠反应可以提供3molH,生成1.5molH2,其在标准状况下的体积为1.5mol×22.4L·mol-1=33.6L;
(5)苹果醋中含有-OH、-COOH;
A.苹果醋中含有-COOH,具有酸性,能够与NaOH反应,A符合题意;
B.苹果醋中含有-OH,可以与乙酸发生酯化反应,B符合题意;
C.苹果醋中含有-COOH,能够与NaHCO3溶液反应生成CO2,C符合题意;
D.苹果醋中含有-COOH,可以与乙醇发生酯化反应,D符合题意;
答案选ABCD。

 阅读快车系列答案
阅读快车系列答案【题目】某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:

(1)根据实验数据可知,该反应在0~4min的平均反应速率v(Cl-)=______mol/(L·min)。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
i.探究化学反应速率增大的影响因素:
已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+
方案 | 假设 | 具体实验操作 |
Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中依次加入10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,______。 |
Ⅱ | 反应产物Cl-对反应有催化作用 | 取10mL 0.1mol/L KClO3溶液于烧杯中,先加入_____固体(填化学式),再加入10mL 0.3mol/L NaHSO3溶液。 |
Ⅲ | 反应中溶液酸性增强,加快了化 学反应速率 | 分别向2个烧杯中加入10mL 0.1mol/L KClO3溶液, 烧杯①:加入1mL水烧杯②:加入1mL 0.2mol/L盐酸再分别向烧杯中加入10mL 0.3mol/L NaHSO3溶液。 |
(问题与思考)
①方案Ⅲ烧杯①中加入1mL水的作用是______。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案III实验操作设计不严谨,改进措施为______。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设_______。
ii.反应后期,化学反应速率降低的主要原因是______。