题目内容
【题目】氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品。
(1) 等物质的量的氨和联氨分别与足量二氧化氮反应,产物为氮气和水。则转移的电子数之比为___________。
(2) 联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂N-H、N-N及N≡N各1 mol需吸收的能量依次为390.8 kJ、193 kJ、946 kJ。若生成1 mol N2,则反应________(填“放出”或“吸收”)___ _______kJ的能量。
(3)NH3-O2燃料电池的结构如图所示。
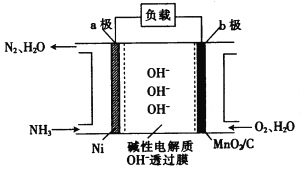
① a极为电池的________(填“正”或“负”)极。
②当生成1 mol N2时,电路中流过电子的物质的量为_____________。
(4)联氨可以高效地脱除烟道气中的NO从而生成 N2,该反应中氧化产物与还原产物的物质的量之比为__________。
【答案】
(1)3 : 4;
(2)放出;367
(3)①负;②6 mol;
(4)1 : 1;
【解析】
试题分析:(1)等物质的量的氨和联氨分别与足量二氧化氮反应,产物为氮气和水,氨气中N的化合价由-3价变成0价,N2H4 N的化合价由-2价变成0价,则转移的电子数之比为1×3:1×2×2=3:4,故答案为:3:4;
(2) 3N2H4(g)=N2(g)+4NH3(g)△H=3(390.8 ×4+193)-(946+4×3×390.8)=-367kJ/mol,则生成1 mol N2,需要放出367 kJ的能量,故答案为:367;
(3)① a极通入氨气,是负极,b极通入氧气,是正极,故答案为:负极;
②氨气中N的化合价由-3价变成0价,当生成1 mol N2时,转移电子的物质的量为6mol,故答案为:6mol;
(4)联氨可以高效地脱除烟道气中的NO从而生成 N2,反应的方程式为N2H4+2NO= 2N2+2H2O,该反应中氧化产物为N2,还原产物为N2,物质的量之比为1:1,故答案为:1:1。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案