题目内容
如下图所示,把锌片和铜片用导线相连后插入装有稀硫酸溶液的烧杯中构成原电池。下列叙述正确的是
| A.Zn是负极,发生还原反应 |
| B.电流从锌片流向铜片 |
| C.一段时间后,铜片质量减轻 |
| D.该装置将化学能转变为电能 |
D
解析试题分析:该装置可构成原电池,是将化学能转变为电能的装置。锌做负极,铜做正极,负极反应氧化反应,正极发生还原反应。电子从负极流向正极。所以答案选D
考点:考查原电池性质的相关知识点

 小学课时特训系列答案
小学课时特训系列答案某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)如图,是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |
请计算待测烧碱溶液的浓度为 。
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是 ;
H2O2参加反应的离子方程式为 。
(2)加稀氨水调节pH的目的是 ,pH应调至 范围。下列物质可用来替代稀氨水的是 。
①NaOH ②Fe2O3 ③CuO ④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括 、 、
过滤、 、干燥等步骤。
下列与金属腐蚀有关的说法正确的是( )
| A.图a中,插入海水中的铁棒越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )。
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
下图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒。下列关于此装置的叙述中,不正确的是( )
| A.N上有气体放出 |
| B.M为负极,N为正极 |
| C.化学能转变为电能的装置 |
| D.导线中有电流通过,电流方向由M到N |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O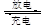 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是( )
| A.充电过程是化学能转化为电能的过程 |
| B.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
| C.放电时负极附近溶液的碱性增强 |
| D.放电时电解质溶液中的OH-向正极移动 |
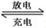 Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
