题目内容
现有A、B、C、D四种金属片:
①把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解;
②把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。
根据上述情况,下列说法中正确的是( )
A.在①中,金属片B发生还原反应
B.在②中,金属片C作正极
C.如果把B、D用导线连接后同时浸入稀硫酸中,则金属片D上有气泡产生
D.上述四种金属的活动性由强到弱的顺序是:A>B>C>D
C
解析试题分析:A.①把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解;则活动性B>A,B发生氧化反应,错误;B.在②中,由于金属片C发生氧化反应,所以C作负极,错误;②把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应;则活动性C>D;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。则活动性A>C.所以四种金属活动性由强到弱的顺序是:B>A> C>D,选项D错误。如果把B、D用导线连接后同时浸入稀硫酸中,由于活动性B> D,则金属片D作正极,在D上氢离子得到电子产生氢气,所以有气泡产生,故选项C正确。
考点:考查金属活动性强弱比较的知识。

如下图所示,把锌片和铜片用导线相连后插入装有稀硫酸溶液的烧杯中构成原电池。下列叙述正确的是
| A.Zn是负极,发生还原反应 |
| B.电流从锌片流向铜片 |
| C.一段时间后,铜片质量减轻 |
| D.该装置将化学能转变为电能 |
钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为
| A.Fe-2e-=Fe2+ | B.Fe-3e-=Fe3+ | C.O2+2H2O+4e-=4OH- | D.2H++2e-= H2 ↑ |
某原电池装置如下图所示。下列有关叙述中,正确的是
A. 作正极,发生氧化反应 作正极,发生氧化反应 | B.工作一段时间后,两烧杯中溶解 均不变 均不变 |
C.负极反应: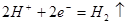 | D.工作一段时间后,NaCl溶液中c(Cl-)增大 |
一种氢氧燃料电池用30%KOH溶液为电解质溶液,有关这种电池的说法中错误的是
| A.H2在负极发生氧化反应 | B.供电时的总反应为:2H2 + O2 = 2H2O |
| C.产物为无污染的水,属于环境友好电池 | D.负极反应为:H2 - 2e- = 2H+ |
如下图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述中正确的是 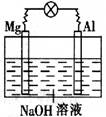
| A.镁比铝活泼,镁失去电子被氧化成Mg2+。 |
| B.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成 |
| C.该装置的内、外电路中,均是电子的定向移动形成电流 |
| D.该装置开始工作时,铝片表面的氧化膜可不必处理 |
观察下列几个装置示意图,有关叙述正确的是
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源负极相连 |
| C.装置③中外电路电子由b极流向a极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
如下图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.装置中发生反应的离子方程式为:2Cl-+2H+通电Cl2↑+H2↑ |
| C.该装置是将电能转化为化学能 |
| D.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
