题目内容
12.下表是不同温度下水的离子积的数据:| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是升高温度,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a:b=1:1.
②若所得混合液pH=2,则a:b=9:11.
分析 (1)根据水的电离过程为吸热反应判断;
(2)根据硫酸钠的化学式组成判断c(Na+):c(SO42- );根据常温下氢离子浓度计算c(Na+):c(OH-);
(3)在t2温度下,水的离子积为1×10-12.
①若所得混合液为中性,酸碱恰好完全反应;
②若所得混合液的pH=2,酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{总}}$计算.
解答 解:(1)水是弱电解质,存在电离平衡,电离过程为吸热反应,所以温度升高,水的电离程度增大,离子积增大,
故答案为:>;升高温度,水的电离程度增大,离子积增大;
(2)硫酸钠溶液中一定满足c(Na+):c(SO42- )=2:1;硫酸钠溶液中c(Na+):c(OH-)=2×5×10-4 mol•L-1:1×10-7 mol•L-1=1000:1,
故答案为:1000:1;
(3)在t2温度下,水的离子积为1×10-12.当显中性时,c(H+)=c(OH-)=1×10-6mol/L,溶液的pH=6,故pH=7的溶液显碱性.
①若所得混合液为中性,酸碱恰好完全反应,则有0.1mol/L×aL=0.1mol/L×bL,a:b=0.1:0.1=1:1,
故答案为:1:1;
②若所得混合液的pH=2,酸过量,c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{总}}$=$\frac{0.1mol/L×bL-0.1mol/L×aL}{(a+b)L}$=0.01,
解之得:a:b=9:11,
故答案为:9:11.
点评 本题考查酸碱混合pH的计算,明确浓度与pH的换算、酸碱混合溶液为中性、碱性时离子浓度的关系等是解答本题的关键,题目难度中等.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
20. A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )
A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )
 A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )
A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )| A. | 由A、B、E三种元素共同形成的化合物都含有共价键,水溶液都呈酸性 | |
| B. | C、D分别形成的简单离子的氧化性:C>D | |
| C. | 电解C、E形成的化合物水溶液可生成C、E对应的单质 | |
| D. | C元素所在周期中离子半径最小的是E元素形成的离子 |
3.下列叙述正确的是( )
| A. | 1 mol氢氧根离子与1 mol羟基所含电子数均为l0NA | |
| B. | 因为电负性O>N,所以H-O的键能比N-H的键能大,所以水的沸点高于氨气 | |
| C. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4NA | |
| D. | 1 mol SiO2晶体中含有Si-O键数目为2NA |
1.下列说法中正确的是( )
| A. | 任何化学反应都能设计成原电池 | |
| B. | 手机上用的锂离子电池属于一次电池 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |

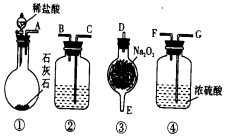 实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
 如图为实验室某浓盐酸试剂瓶标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据