题目内容
17.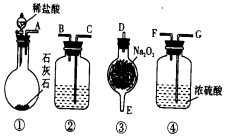 实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.(1)装置②中所盛溶液最好选用C.
A.饱和食盐水 B.饱和NaHCO3溶液
C.澄清石灰水 D.NaCl溶液
(2)如果将所制气体从左至右流向排列装置时,上述各仪器装置连接的正确顺序是(填写装置的编号)①接③接②接④,
(3)装置②的作用是除去反应中过量的CO2,发生反应的离子方程式是CO2+Ca2++2OH--=CaCO3↓+H2O.
分析 (1)装置②目的是除去反应中过量的CO2;
(2)仪器的连接方法:先制备反应物,然后除杂质,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用CO2和Na2O2反应制O2,据此答题;
(3)装置②作用是除去反应中过量的CO2;除二氧化碳用澄清石灰水,澄清石灰水和二氧化碳反应生成碳酸钙和水.
解答 解:(1)装置②目的是除去反应中过量的CO2,故用碱性物质澄清石灰水,注意选项B,虽然是碱性物质,但是饱和二氧化碳不溶于饱和NaHCO3溶液,
故答案为:C;
(2)仪器的连接方法:先制备反应物,然后除杂质,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用CO2和Na2O2反应制O2,则应先制取CO2,再与Na2O2反应,最后除杂,并收集气体,故仪器连接顺序为①③②④,
故答案为:①;③;②;④;
(3)装置②的作用是除去反应中过量的CO2;除二氧化碳用澄清石灰水,澄清石灰水和二氧化碳反应生成碳酸钙和水,CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:除去反应中过量的CO2;CO2+Ca2++2OH--=CaCO3↓+H2O.
点评 本题难度不大,理解常温下CO2能和Na2O2反应制取O2的实验,明确实验过程中带来的气体杂质有H2O和CO2,选择合适的试剂并将其除去是解题的关键.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
5.有机物a和苯通过反应合成b的过程可表示为图 (无机小分子产物略去).下列说法正确的是( )

| A. | 该反应是加成反应 | |
| B. | 若R为CH3时,b中所有原子可能共面 | |
| C. | 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种 | |
| D. | 若R为C4H5O时,lmol b最多可以与6mol H2加成 |
12.下表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是升高温度,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a:b=1:1.
②若所得混合液pH=2,则a:b=9:11.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是升高温度,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a:b=1:1.
②若所得混合液pH=2,则a:b=9:11.
9. 在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
 在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )| A. | △H>0 | B. | AB一定是气体物质 | ||
| C. | 反应温度a低于b | D. | A2、B2中最少有一种是气态物质 |
6.下列图示的实验中,能用于分离酒精和水的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
 工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.
工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.