题目内容
V L浓度为1 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
| A.通入标准状况下的HCl气体22.4V L |
| B.将溶液加热浓缩到0.5V L |
| C.加入10 mol·L-1的盐酸0.2V L,再稀释至1.5V L |
| D.加入V L 3 mol·L-1的盐酸混合均匀 |
C
解析试题分析:A、通入气体后,溶液的体积不再是VL;B、加热浓缩时盐酸会挥发;C、根据C(HCl)= 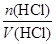 可得C(HCl)=
可得C(HCl)=  =2 mol·L-1,故C正确;D、混合溶液体积不能相加。
=2 mol·L-1,故C正确;D、混合溶液体积不能相加。
考点:考查物质的量浓度的计算。

练习册系列答案
相关题目
下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是
| A.150 mL 1 mol·L-1的NaCl溶液 | B.75 mL 2 mol·L-1 NH4Cl溶液 |
| C.150 mL 2 mol·L-1的KCl溶液 | D.75 mL 1 mol·L-1的FeCl3溶液 |
在标况下,将O2与NO2按1:4的体积比充满于一真空干燥烧瓶中,然后将烧瓶倒置于水中,瓶中液面逐渐上升后,至几乎完全充满烧瓶,最终烧瓶内溶液的物质的量浓度最接近于
| A.0.026mol/L | B.0.030mol/L | C.0.036mol/L | D.0.045mol/L |
与0.2mol H2O含有相同氢原子数的是
| A.0.2molHNO3 | B.标况下2.24L CH4 |
| C.1.7g NH3 | D.1.505×1022个HCl分子 |
NA表示阿伏加德罗常数。下列说法正确的是( )
| A.0.1mol Na2O2中含有的阴离子数目为0.2NA |
| B.标准状况下,2.24 L CHCl3的分子数为0.1NA |
| C.1 L 0.1 mol·L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA |
| D.9.2 g NO2和N2O4的混合气体中含有的氮原子数为0.2NA |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.46g乙醇中含有的化学键数为7NA |
| B.1mol氯气和足量NaOH溶液反应转移电子数为2NA |
| C.1molOH-和1mol–OH(羟基)中含有的质子数均为9NA |
| D.10L0.1mol·L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
用密度1.19g/cm3质量分数为37%的浓盐酸配制稀盐酸:①用浓盐酸与等体积的水混合后所得稀盐酸的质量分数为a%②用浓盐酸与等质量的水混合后所得的稀盐酸的质量分数为b%,那么a与b的关系正确的是
| A.a>b | B.a="b" | C.a<b | D.无法确定 |