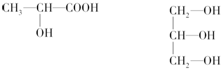题目内容
20.已知2SO2(g)+O2(g)?2SO3(g)(正反应放热).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )| A. | 升高温度,可以加快反应速率 | |
| B. | 降低温度,可以加快反应速率 | |
| C. | 在上述条件下,SO2能完全转化为SO3 | |
| D. | 任何情况,达到平衡时,SO2和SO3的浓度都一定相等 |
分析 A、根据升高温度,反应速率加快;
B、根据降低温度,反应速率减慢;
C、根据可逆反应不可能完全进行到底;
D、平衡状态时浓度不变.
解答 解:A、因升高温度,单位体积内的活化分子数增多,所以反应速率加快,故A正确;
B、因降低温度,单位体积内的活化分子数减少,所以反应速率减慢,故B错误;
C、因可逆反应不可能完全进行到底,所以SO2不能完全转化为SO3,故C错误;
D、因平衡状态时SO2和SO3的浓度不变,而不是相等,浓度是否相等,与起始量和转化率有关,故D错误;
故选:A.
点评 本题主要考查了影响化学反应速率的因素以及影响化学平衡移动的因素和转化率相关知识,难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
10.下列说法或表示法正确的是( )
| A. | 在稀溶液中:H++OH-═H2O;△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ | |
| B. | 由4P(s,红磷)═P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol-1,则H2的燃烧热等于241.8 kJ•mol-1 | |
| D. | 己知:S(g)+O2(g)═SO2(g);△H1及S(s)+O2(g)═SO2(g):△H2,则△H1<△H2 |
11.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 乙醇与钠反应:2CH3CH2O-+2H++2Na→2CH3CH2ONa+H2↑ | |
| C. | 苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 苯酚溶液中加入溴水: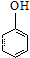 +3B2→ +3B2→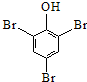 ↓+3H++3Br- ↓+3H++3Br- |
8.下面有机物的同系物中,完全燃烧产生的水和二氧化碳的物质的量之比恒定的是①饱和一元醇②饱和一元醛③饱和一元羧酸④饱和一元醇和饱和一元羧酸生成的酯⑤乙炔的同系物⑥苯的同系物( )
| A. | ①④ | B. | ②③④⑤⑥ | C. | ②③ | D. | ②③④ |
15.以下物质一定条件下可与水反应的是( )
| A. | Fe | B. | Al(OH)3 | C. | NO | D. | H2SO3 |
5.实验中需用2.0mol/L的Na2CO3溶液950mL,配制时应称取Na2CO3固体的质量为( )
| A. | 201.4 g | B. | 212.0 g | C. | 21.2 g | D. | 100.7 g |
16.下列原子轨道能量最大的是( )
| A. | 3d | B. | 2p | C. | 5f | D. | 4s |
 ,电子排布式1s22s22p63s23p63d14s2.该元素的原子序数为21,该元素是金属元素(填“金属”或“非金属”),形成的单质为金属晶体.
,电子排布式1s22s22p63s23p63d14s2.该元素的原子序数为21,该元素是金属元素(填“金属”或“非金属”),形成的单质为金属晶体.