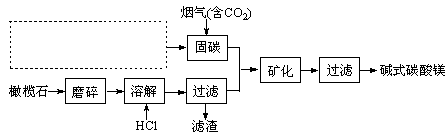
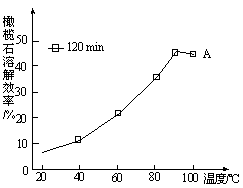
题目内容
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
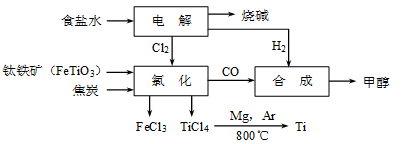
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,
再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。

请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)
 CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。(1)四;IVB(2分)
(2)2FeTiO3+6C+7Cl2 2FeCl3+ 2TiCl4+6CO(2分)
2FeCl3+ 2TiCl4+6CO(2分)
(3)TiCl4+(2+x)H2O TiO2·xH2O+4HCl,加入大量水并加热,氯化氢挥发,使平衡正向移动,促进水解趋于完全(或促使水解正向进行) (2分)
TiO2·xH2O+4HCl,加入大量水并加热,氯化氢挥发,使平衡正向移动,促进水解趋于完全(或促使水解正向进行) (2分)
(4)防止钛、镁被氧化(或防止钛镁与空气、水反应)(2分),1412(2分)
(5) (或
(或 %)(2分)
%)(2分)
(6)5(2分)
(2)2FeTiO3+6C+7Cl2
 2FeCl3+ 2TiCl4+6CO(2分)
2FeCl3+ 2TiCl4+6CO(2分)(3)TiCl4+(2+x)H2O
 TiO2·xH2O+4HCl,加入大量水并加热,氯化氢挥发,使平衡正向移动,促进水解趋于完全(或促使水解正向进行) (2分)
TiO2·xH2O+4HCl,加入大量水并加热,氯化氢挥发,使平衡正向移动,促进水解趋于完全(或促使水解正向进行) (2分)(4)防止钛、镁被氧化(或防止钛镁与空气、水反应)(2分),1412(2分)
(5)
 (或
(或 %)(2分)
%)(2分) (6)5(2分)
考点分析:本题需认真解读题给的信息,根据流程图可知(2)中的方程式为2FeTiO3+6C+7Cl2
 2FeCl3+
2FeCl3+2TiCl4+6CO,同样(3)也需要根据提示利用化学平衡的移动原理解题;(4)中结合各种物质的熔沸点确定温度略高于14120C可将Ti分离,而(5)中则利用氧化还原反应利用Ti3+――Ti4+
Fe3+――Fe2+,消耗的NH4Fe(SO4)2的物质的量为c V/1000,所以Ti的物质的量也为c V/1000,TiO2的质量为c VM/1000,其质量分数为c VM/1000w,(6) 结合方程式2FeTiO3+6C+7Cl2
 2FeCl3+ 2TiCl4+6CO,生成6molCO同时食盐水电解生成7molCl2,而产生的H2也为7mol,由方程式
2FeCl3+ 2TiCl4+6CO,生成6molCO同时食盐水电解生成7molCl2,而产生的H2也为7mol,由方程式CO(g)+2H2(g)
 CH3OH(g),可知还需要5molH2。
CH3OH(g),可知还需要5molH2。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1