题目内容
2.(1)在标准状况下16克气体X的体积为5.6L,则此气体的摩尔质量为多少65g/mol(2)常温下,在78g水中溶解32g CuSO4,恰好达到饱和,该溶液密度为1.2g/cm3,求:
①该溶液溶质质量分数29.1%
②该溶液中CuSO4的物质的量浓度2.18 mol/L
③取出20.0ml该溶液,配成浓度为0.50mol/L的稀溶液,则稀释后溶液的体积是87.2L.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算气体物质的量,再根据M=$\frac{m}{n}$计算气体的摩尔质量;
(2)①溶质质量分数=$\frac{溶质质量}{溶液质量+溶剂质量}$×100%;
②根据n=$\frac{m}{M}$计算硫酸铜的物质的量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算;
③根据稀释定律计算.
解答 解:(1)标况下,5.6L X气体物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,气体的摩尔质量=$\frac{16g}{0.25mol}$=64g/mol,故答案为:64g/mol;
(2)①溶质质量分数=$\frac{32g}{78g+32g}$×100%=29.1%,故答案为:29.1%;
②硫酸铜的物质的量为$\frac{32g}{160g/mol}$=0.2mol,溶液体积=$\frac{110g}{1200g/L}$=$\frac{11}{120}$L,溶液物质的量浓度为$\frac{0.2mol}{\frac{11}{120}L}$=2.18 mol/L,故答案为:2.18 mol/L;
③设需稀释后溶液的体积是V,根据稀释定律,则:
20mL×2.18 mol/L=V×0.50mol/L
解得V=87.2mL
故答案为:87.2L.
点评 本题考查物质的量浓度有关计算、物质的量有关计算,难度不大,注意对公式的理解与灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| C. | 1000mL0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 质量为32g的O3和O2的混合物中含有的氧原子数为NA |
10.下列各物质所含分子数目,按由大到小顺序排列的是( )
①0.2mol NH3
②标准状况下22.4L Ne
③4℃9mL 水
④含有1.806x1023个原子的SO2.
①0.2mol NH3
②标准状况下22.4L Ne
③4℃9mL 水
④含有1.806x1023个原子的SO2.
| A. | ①④②③ | B. | ②③④① | C. | ②③①④ | D. | ①④③② |
17.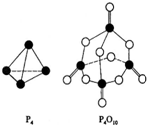 白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
 白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
白磷在氧气中燃烧放热,反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )| A. | 6a+5d<4c+10b | B. | △H=(4c+12b-6a-5d) kJ•mol-1 | ||
| C. | 6a+5d<4c+12b | D. | △H=(6a+5d-4c-12b) kJ•mol-1 |
14.若已知氧化性顺序:C2>A3+>B2,还原性顺序:B->A2+>C-,则下列反应在水溶液中不可能发生的是( )
| A. | 2A3++2B-═2A2++B2 | B. | C2+2B-═2C-+B2 | ||
| C. | 2A2++C2═2A3++2C- | D. | B2+2C-═C2+2B- |
11.实验室欲用Na2CO3﹒10H2O晶体配制1mol/L的Na2CO3溶液100mL,下列说法正确的是( )
| A. | 要完成实验需称取10.6gNa2CO3﹒10H2O晶体 | |
| B. | 本实验需用到的仪器是天平、药匙、玻璃棒、烧杯、100mL容量瓶 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |
12.由2-氯丙烷制取丙烯时,发生的反应类型是( )
| A. | 消去 | B. | 加成 | C. | 取代 | D. | 氧化 |