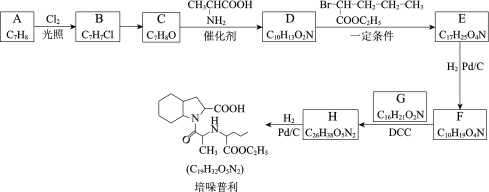
��Ŀ����
����Ŀ��ij��ѧ��ȤС��������ͼװ���Ʊ��������������۲�����ɫ���ṩ��ѧҩƷ�����ۡ�ϡ���ᡢ����������Һ��
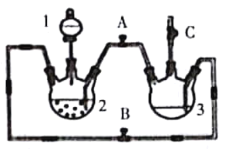
(1)ϡ����Ӧ����_________��(��д��������)��
(2)��ʵ��ͨ������A��B��C�������أ��������еĿ����ž����ٹرտ���______������_________�Ϳɹ۲쵽��������������ɫ���Է���ʵ�鿪ʼʱ�ž�װ���п���������____________��
(3)��ʵ��ʹ�����ۣ�����Ӧ���ʿ���̫���⣬�����ܻ���ɵIJ��������_______________��
(4)��FeSO4��Һ�м���(NH4)2SO4������Ʊ�Ħ�������������[(NH4)2SO4��FeSO4��6H2O](�þ����һ���������ȶ� �����ױ�������������ˮ���������Ҵ�)������ͼ��ʾ��װ�ó��ˣ�����ͨ©��������ȣ����˵��ŵ���_____________________________��
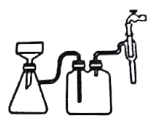
��Ϊϴ��(NH4)2SO4��FeSO4��6H2O�ֲ�Ʒ�����з���������ʵ���____��
A������ˮϴ
B��������ˮϴ��������ˮ�Ҵ�ϴ
C����30%���Ҵ���Һϴ
D����90%���Ҵ���Һϴ
�ڲⶨĦ���������ĺ�������ȡag��Ʒ����ƿ�У��ܽ���ϡ�����ữ����c mol��L-1������KMnO4��Һ�ζ����յ㣬�ζ��յ��������_______________�������յ�����KMnO4�����ΪVmL����þ������������������ı���ʽΪ_______________________(����ĸa��c��V ��ʾ)��
��ʵ���ҿ���______( ���Լ�����)����Fe2+���ڣ�����������ɫ���������ӷ���ʽΪ_________________��
���𰸡���Һ©�� B A(��AC) ��ֹ���ɵ����������������� ���۽��뵼�ܴӶ��������� �����ٶȿ� D ���������һ�α�Һʱ����Һ����ɫ��Ϊdz��ɫ����30s����ɫ ![]() ���軯��
���軯�� ![]()
��������
����ͼװ���Ʊ��������������۲�����ɫ���ṩ��ѧҩƷ�����ۡ�ϡ���ᡢ����������Һ�����װ�÷�����֪������BC���ر�A����Ҫ��������ƿ2�м��������ʣ���Һ©������ϡ���ᣬ���÷�Ӧ���������ž�װ���еĿ����������ռ�C������������Ƿ��Ǵ������������������еĿ����ž���Ȼ��ر�B������AC���������ɵ�������װ��2��ѹǿ��������������Һѹ��װ��3������������Һ�У���Ӧ����������������ɫ�������Դ˽����⡣
(1)��ʵ��Ŀ�����Ʊ���������������������ϡ���ᷴӦ�Ʊ������������˷�Ӧ��װ��2�н��У�ϡ��������Һ��Ӧʢ���ڷ�Һ©���У���Ӧʢ����1����
�ʴ�Ϊ����Һ©����
(2)��B��C���ر�A������װ��2�в�������������װ��3�еĿ����ž���ʹװ�ô��ڻ�ԭ��Χ��Ȼ��ر�B����A����������ѹǿ���Ѳ�����FeSO4ѹ�뵽װ��3�У�����Fe(OH)2��������������Һ���ױ������е�����������������������������������������ɫ�Ĺ۲�������ţ�����Ҫ�ų�װ���еĿ�������ֹ���ɵ�������������������
�ʴ�Ϊ��B��A��(AC)����ֹ���ɵ�������������������
(3)������ѹǿ������������Һѹ�뵽װ��3��ʱ��Ҳ�п��ܰ�����ѹ�뵽�����У����������ܣ�
�ʴ�Ϊ�����۽��뵼�ܴӶ��������ܣ�
(4)���˿ɼӿ�ˮ�����٣��ӿ�����ٶȣ�
����Ϊ���������������ˮ���������Ҵ���Ӧ�����Ҵ�ϴ�ӣ�������������淋��ܽ⣬ͬʱ�����Ҵ���ˮ���ܣ��Ӷ��ﵽϴ�ӵ�Ҫ��ѡD��
����c mol��L-1������KMnO4��Һ�ⶨĦ���������ĺ������������ӱ���������ʹ���������ɫ�����������һ�α�Һʱ����Һ����ɫ��Ϊdz��ɫ����30s����ɫ�����ﵽ�ζ��յ㣻����������������ӵĶ�Ӧ��ϵΪ��![]() ���ʲ��뷴Ӧ����������Ϊ��
���ʲ��뷴Ӧ����������Ϊ��![]() ���þ������������������ı���ʽΪ
���þ������������������ı���ʽΪ![]() ��
��
��)����Fe2+���ڣ�����������ɫ��������ѡ���Լ����軯�أ��������ӷ�Ӧ��![]() ��
��
�ʴ�Ϊ�������ٶȿ죻D�����������һ�α�Һʱ����Һ����ɫ��Ϊdz��ɫ����30s����ɫ��![]() �����軯�أ�
�����軯�أ�![]() ��
��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�����Ŀ�������ϵĵ�Ԫ�ضԶ�ֲ������Ҫ���ã����а��ĺϳ���Ӧ���ǵ�ǰ���о��ȵ㡣
��1����ͬ�¶��¹�ҵ�ϳɰ�N2(g)+3H2(g)![]() 2NH3(g)��Ӧ�IJ���Kֵ���±���
2NH3(g)��Ӧ�IJ���Kֵ���±���
�¶�/�� | 25 | 400 | 450 |
K | 5��108 | 0.507 | 0.152 |
�ٹ�ҵ�ϳɰ���Ӧƽ�ⳣ������ʽΪK=___��
������ƽ�ⳣ�����ͣ��÷�ӦΪ���ȷ�Ӧ������___��
�۴�ƽ���ӽǿ��ǣ���ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ��500�����ҵĸ��£�������ԭ��___��
��2����ѧ�����õ�ⷨ�ڳ��³�ѹ��ʵ�ֺϳɰ�������ʱ����������ʾ��ͼ��ͼ�����е��ҺΪ�ܽ�����������﮺��Ҵ��Ķ����л��ܼ���
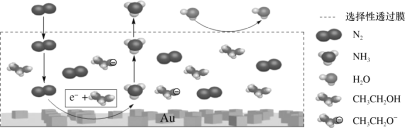
������������NH3�ĵ缫����ʽΪ___��
������˵������ȷ����___������ĸ��ţ���
a.��������﮵���������ǿ������
b.��װ���ý�(Au)������Ŀ���ǽ���N2�ļ���
c.ѡ������Ĥ������N2��NH3ͨ������ֹH2O����װ��
����Ŀ����1���Ҵ��ķ���ʽ��C2H6O�������л����ձ����ͬ���칹������ṹ��ʽ����Ϊ��
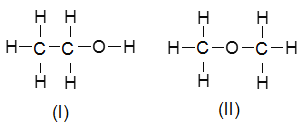
Ϊȷ����ṹ��Ӧ�������ʵ��������ʽ��ж��ԡ�����ʵ�顣�ָ����Ҵ����Ƽ���Ҫ����������ͬѧֱ��������ͼ����װ�ÿ�ʼ����ʵ��ȷ���Ҵ��Ľṹ��

ijͬѧ�õ�һ��ʵ�����ݣ�
�Ҵ������ʵ�����mol�� | �����������L�� |
0.10 | 1.12����״���� |
�������������ж��Ҵ��Ľṹ��Ϊ____��I��II��������Ϊ____��
��2��ijʵ��С��������װ�ý����Ҵ���������ʵ�顣

��ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д����Ӧ�Ļ�ѧ����ʽ_____��____��
�ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ�����Ӧ��____��Ӧ��
�ڼ�������ˮԡ���ò���ͬ����������___���ҵ�������_____��
�۷�Ӧ����һ��ʱ������a�����ռ�����ͬ�����ʣ�������___������ƿ���ռ������������Ҫ�ɷ���___��
�����Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л�����___��Ҫ��ȥ�����ʣ����ڻ��Һ�м���___����д��ĸ����
a���Ȼ�����Һ b���� c��̼��������Һ d�����Ȼ�̼
Ȼ����ͨ��____����ʵ��������ƣ����ɳ�ȥ��