题目内容
【题目】某同学设计如下实验方案,以分离NaCl和BaCl2两种固体混合物,回答下列问题:
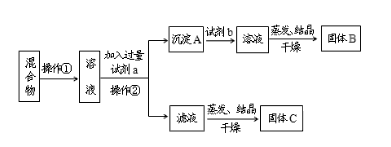
供选试剂:Na2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是_____。
(2)试剂a是____(填化学式,下同),试剂b是___,固体B是____。
(3)加入试剂a、b分别所发生的化学反应方程式为____、____。
(4)该方案能否达到实验目的___。若不能,应如何改进(若能,此问不用回答)____。
【答案】过滤 Na2CO3 HCl BaCl2 BaCl2+Na2CO3=BaCO3↓+2NaCl BaCO3+2HCl=BaCl2+H2O+CO2↑ 不能 向滤液中滴加适量稀盐酸后再蒸发结晶
【解析】
由题给流程可知,先将NaCl和BaCl2两种固体混合物溶于水配成溶液,然后加入过量Na2CO3溶液,Na2CO3溶液与溶液中BaCl2反应生成碳酸钡沉淀和氯化钠,过滤,向沉淀中加入盐酸,盐酸与碳酸钡反应生成氯化钡、二氧化碳和水,将反应生成的BaCl2溶液蒸发、结晶、干燥得到氯化钡固体,操作②所得滤液为氯化钠和碳酸钠的混合溶液,将混合溶蒸发、结晶、干燥得到的固体为氯化钠和碳酸钠混合物。
(1)操作②为过滤分离碳酸钡沉淀和氯化钠溶液,故答案为:过滤;
(2)试剂a是Na2CO3溶液,加入Na2CO3溶液的目的是与溶液中BaCl2反应生成碳酸钡沉淀和氯化钠;试剂b是盐酸,加入盐酸的目的是与碳酸钡反应生成氯化钡、二氧化碳和水得到氯化钡溶液;将反应生成的BaCl2溶液蒸发、结晶、干燥得到氯化钡固体,则固体B是氯化钡,故答案为:Na2CO3;HCl;BaCl2;
(3)试剂a是Na2CO3溶液,加入过量Na2CO3溶液,Na2CO3溶液与溶液中BaCl2反应生成碳酸钡沉淀和氯化钠,反应的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl;试剂b是盐酸,加入盐酸,盐酸与碳酸钡反应生成氯化钡、二氧化碳和水,反应的化学方程式为BaCO3+2HCl=BaCl2+H2O+CO2↑,故答案为:BaCl2+Na2CO3=BaCO3↓+2NaCl;BaCO3+2HCl=BaCl2+H2O+CO2↑;
(4)操作②所得滤液为氯化钠和碳酸钠的混合溶液,将混合溶蒸发、结晶、干燥得到的固体为氯化钠和碳酸钠混合物,则该方案不能达到实验目的;应向混合溶液中加入过量盐酸,盐酸与溶液中碳酸钠溶液反应生成氯化钠、二氧化碳和水,将反应生成的氯化钠溶液蒸发、结晶、干燥得到氯化钠固体,故答案为:不能;向滤液中滴加适量稀盐酸后再蒸发结晶。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表》
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
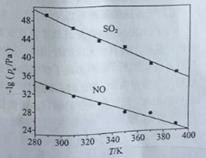
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq) ===SO32(aq)+H2O(l) ΔH1
ClO(aq)+SO32(aq) ===SO42(aq)+Cl(aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH=______。
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________,已知:K(300℃)>K(350℃),该反应是________反应(填“放热”或“吸热”)。
(2)下图中表示NO2的变化的曲线是___,用O2的浓度变化表示从0~2 s内该反应的平均速率v=__________。

(3)能说明该反应已经达到平衡状态的是(____)
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(____)
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂


